Site bölümleri
Editörün Seçimi:
- Rusça yazım ve noktalama kuralları (1956)
- Çocuğu olan bir dul kadını kovmak mümkün mü? Küçük çocuğu olan bir dul kadını kovmak mümkün mü?
- Rektal mukozadaki hasarın tedavisi Neredeyse rektumun yırtılması yaşandı
- Gezegen Üçüncü Dünya Savaşıyla mı karşı karşıya?
- Sodom ve Gomorra'nın Tarihi
- Kutsal Ruh - neden ona ihtiyacımız var Hıristiyan Biliminde kutsal ruh kimdir?
- Yapay gökyüzü aydınlatma bölgeleri
- Baykonur Kozmodromu - dünyadaki ilk kozmodrom
- Transuranyum elementleri Geçiş metalleri neden kötüdür?
- Uzay asansörü ve nanoteknoloji Yörünge asansörü
Reklam
| Doğada ve insan yaşamında kükürt oksit. Sülfür(IV) oksit ve sülfüröz asit |
|
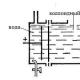
Sülfür(IV) oksidin çoğu sülfürik asit üretmek için kullanılır. Sülfür (IV) oksit ayrıca sülfürik asidin çeşitli tuzlarını elde etmek için de kullanılır. Sülfürik asit, bazlar ve bazik oksitlerle reaksiyona girerek asidik özellikler gösterir. Sülfürik asit dibazik olduğundan iki dizi tuz oluşturur: orta - sülfatlar, örneğin Na2SO4 ve asidik - hidrosülfatlar, örneğin NaHSO4. Ayrıca etanol ve sülfürik asitte de çözünür. Güçlü indirgeyici ajanların varlığında SO2 oksitleyici özellikler sergileyebilir. Kimyasal tesislerin duman alevlerinden kaynaklanan sülfürik asit aerosolünün serpintisi daha çok alçak bulutlarda ve yüksek nem hava.
Kükürt dioksit, kuzey yarımkürede, özellikle ABD, Avrupa, Çin, Rusya'nın Avrupa kısmı ve Ukrayna'da en yüksek konsantrasyonlara ulaşır. Beyaz bir BaSO4 çökeltisinin (asitlerde çözünmeyen) oluşumu, sülfürik asit ve çözünür sülfatları tanımlamak için kullanılır. Sülfürik asit yalnızca çözelti halinde bulunur. Kükürt trioksit asidik özellikler sergiler. Bu reaksiyon kimya endüstrisinin en önemli ürünü olan sülfürik asidi üretmek için kullanılır. Kükürt trioksit içindeki kükürt nedeniyle en yüksek derece oksidasyon, ardından kükürt (VI) oksit oksitleyici özellikler sergiler. Soru: Asitlerin hangi kimyasal özelliklerini biliyorsunuz? Aynı zamanda koruyucu olarak da kullanılır (gıda katkı maddesi E220). Bu gaz mikroorganizmaları öldürdüğü için sebze depoları ve depoların dezenfekte edilmesinde kullanılır. Demir dışı ve demirli metalurjinin pirometalurji işletmeleri ve termik santraller, her yıl atmosfere on milyonlarca ton sülfürik anhidrit yayar. 4. Kükürtün kendi kendine oksidasyonu-kendi kendine indirgenmesi reaksiyonları, sülfitlerle etkileşime girdiğinde de mümkündür. Böylece SO2, sülfürik asit ve tuzları hem oksitleyici hem de indirgeyici özellikler gösterebilmektedir. Hidrojen sülfür, kükürt, sülfitler, tiyosülfatlar ve sülfürik asit üretiminde ve laboratuvar uygulamalarında sülfitlerin çökeltilmesi için kullanılır. Fosforik, hidroklorik, borik, hidroflorik ve diğer asitlerin üretiminde kullanılır. Asidik oksitlerin tipik özelliklerini gösterir ve suda oldukça çözünür, zayıf sülfürik asit oluşturur. Kimyasal özellikler sülfürik asit büyük ölçüde konsantrasyonuna bağlıdır. Bakır sülfat CuSO4 5H2O tarımda zararlılarla ve bitki hastalıklarıyla mücadele etmek için kullanılır.
Oksidasyon durumu +1 olan kükürt bileşikleri3. Seyreltik sülfürik asidin bir elektrolit olarak özelliklerini karakterize eden reaksiyon denklemlerini yazın. Plastik kükürt koyu renklidir ve kauçuk gibi esneyebilmektedir. Bir oksidin diğerine oksidasyon süreci tersine çevrilebilir. Termal etkiler kimyasal reaksiyonlar. Oksitlerin, hidroksitlerin, hidrojen bileşiklerinin özelliklerinde periyodik değişiklikler kimyasal elementler. Hidrojenin fiziksel ve kimyasal özellikleri. Kararsız sülfürik asit oluşturmak üzere suda çözünür; çözünürlük 20 °C'de 11,5 g/100 g su, artan sıcaklıkla azalır. Sülfür dioksitin bu damar genişletici etkisine ATP'ye duyarlı kalsiyum kanalları ve L tipi kalsiyum kanalları ("dihidropiridin") aracılık eder. Dünya atmosferindeki kükürt dioksit, sera gazlarının (karbon dioksit, metan) atmosfer sıcaklığındaki artış üzerindeki etkisini önemli ölçüde zayıflatır. Sülfür trioksit formlarının çeşitliliği, SO3 moleküllerinin donör-alıcı bağlarının oluşumu nedeniyle polimerleşme yeteneği ile ilişkilidir. SO3 polimer yapıları kolayca birbirine dönüşür ve katı SO3 genellikle bir karışımdan oluşur. çeşitli formlar nispi içeriği sülfürik anhidrit elde etme koşullarına bağlıdır. Demir sülfat FeSO4 · 7H2O daha önce uyuz, helmintiyazis ve bez tümörlerini tedavi etmek için kullanılıyordu ve şu anda tarımsal zararlıları kontrol etmek için kullanılıyor. Glauber tuzu (mirabilit) Na2SO4 · 10H2O, Alman kimyager I.R. Glauber tarafından sülfürik asidin sodyum klorür üzerindeki etkisi ile elde edildi ve tıpta müshil olarak kullanıldı;
Kararsızdır ve kükürt dioksit ve suya ayrışır. Sülfürik asit kuvvetli bir asit değildir. Orta kuvvette bir asittir ve kademeli olarak ayrışır. Sülfürik asit reaksiyona girer üç tip: asit-baz, iyon değişimi, redoks. Bu reaksiyonlar en iyi şekilde seyreltik sülfürik asit ile gerçekleştirilir. Sülfürik asit iyon değişim reaksiyonları ile karakterize edilir. Gaz oluşumu, gazlar (karbonik, kükürt dioksit, hidrojen sülfür) veya hidroklorik asit gibi uçucu asitler oluşturmak üzere ayrışan kararsız asitlerin tuzları ile reaksiyonlarda meydana gelir. Dikkat! Slayt önizlemeleri yalnızca bilgilendirme amaçlıdır ve sunumun tüm özelliklerini temsil etmeyebilir. Ödev: Sülfürik asidin ayrışması için bir denklem yazın.
İlginç bir şekilde SO2 duyarlılığı bireyler, hayvanlar ve bitkiler arasında büyük farklılıklar göstermektedir. Sodyum tiyosülfat, çeşitli oksidasyon durumlarında iki kükürt atomu içerir ve indirgeyici özellikler sergiler. SO2 organik boyaların rengini giderir ve ipek, yün ve samanı ağartmak için kullanılır. Konsantre sülfürik asit, petrol ürünlerini kükürt ve doymamış maddelerden arındırmak için kullanılır. organik bileşikler. Yüksek higroskopisitesinden dolayı gazları kurutmak ve konsantre etmek için kullanılır. nitrik asit. Hidrojen sülfür ve sülfürler. Hidrojen sülfür suda çözündüğünde, tuzlarına sülfür adı verilen zayıf hidrosülfit asit oluşur. Bir dibazik asit olarak sülfürlü asit tuzları, orta - sülfitler, örneğin sodyum sülfit Na2S03 ve asidik - hidrosülfitler, örneğin sodyum hidrosülfit NaHSO3 olabilir. Laboratuvarlarda solvent olarak da kullanılır. Öğretmen: Sülfürik asit kararsız bir bileşiktir, kolayca sülfür oksit (IV) ve suya ayrışır, bu nedenle yalnızca sulu çözeltilerde bulunur. Absorbsiyon kulesinde kükürt oksit (VI), konsantre sülfürik asit tarafından emilir. Eğitimi nedeniyle büyük miktarlar Atık olarak kükürt dioksit atmosferi kirleten başlıca gazlardan biridir. Kükürt oksit (kükürt dioksit, kükürt dioksit, kükürt dioksit), normal koşullar altında keskin karakteristik bir kokuya sahip (yanan kibrit kokusuna benzer) renksiz bir gazdır. Basınç altında sıvılaştırılmış oda sıcaklığı. Kükürt dioksit suda çözünür ve kararsız sülfürik asit oluşur. Bu madde aynı zamanda sülfürik asit ve etanolde de çözünür. Bu, volkanik gazları oluşturan ana bileşenlerden biridir. Kükürt dioksit SO2 - kükürt dioksit elde edilmesi - endüstriyel olarak kükürtün yakılması veya sülfitlerin kavrulmasından oluşur (çoğunlukla pirit kullanılır). 4FeS2 (pirit) + 11O2 = 2Fe2O3 + 8SO2 (kükürt dioksit). Laboratuvar ortamında, hidrosülfitlerin ve sülfitlerin güçlü asitlerle işlenmesiyle kükürt dioksit üretilebilir. Bu durumda ortaya çıkan sülfürik asit hemen su ve sülfür dioksite ayrışır. Örneğin: Na2SO3 + H2SO4 (sülfürik asit) = Na2SO4 + H2SO3 (sülfürlü asit). Kükürt dioksit üretmenin üçüncü yöntemi, konsantre sülfürik asidin ısıtıldığında düşük aktif metaller üzerindeki etkisini içerir. Örneğin: Cu (bakır) + 2H2SO4 (sülfürik asit) = CuSO4 (bakır sülfat) + SO2 (kükürt dioksit) + 2H2O (su). Kükürt dioksitin kimyasal özellikleri Sülfür dioksitin formülü SO3'tür. Bu madde asit oksitlere aittir. 1. Kükürt dioksit suda çözünür ve sonuçta sülfürik asit oluşur. Normal koşullar altında bu reaksiyon tersine çevrilebilir. SO2 (kükürt dioksit) + H2O (su) = H2SO3 (sülfürlü asit). 2. Alkalilerle kükürt dioksit sülfitler oluşturur. Örneğin: 2NaOH (sodyum hidroksit) + SO2 (kükürt dioksit) = Na2SO3 (sodyum sülfit) + H2O (su). 3. Kükürt dioksitin kimyasal aktivitesi oldukça yüksektir. Sülfür dioksitin indirgeyici özellikleri en belirgindir. Bu tür reaksiyonlarda kükürtün oksidasyon durumu artar. Örneğin: 1) SO2 (kükürt dioksit) + Br2 (brom) + 2H2O (su) = H2SO4 (sülfürik asit) + 2HBr (hidrojen bromür); 2) 2SO2 (kükürt dioksit) + O2 (oksijen) = 2SO3 (sülfit); 3) 5SO2 (kükürt dioksit) + 2KMnO4 (potasyum permanganat) + 2H2O (su) = 2H2SO4 (sülfürik asit) + 2MnSO4 (mangan sülfat) + K2SO4 (potasyum sülfat). Son reaksiyon, SO2 ve SO3'e verilen kalitatif reaksiyonun bir örneğidir. Çözeltinin rengi mor olur.) 4. Güçlü indirgeyici maddelerin varlığında kükürt dioksit oksitleyici özellikler sergileyebilir. Örneğin metalurji endüstrisinde egzoz gazlarından kükürtün çıkarılması için kükürt dioksitin karbon monoksit (CO) ile indirgenmesini kullanırlar: SO2 (kükürt dioksit) + 2CO (karbon monoksit) = 2CO2 + S (kükürt). Ayrıca bu maddenin oksitleyici özellikleri fosfor asit elde etmek için kullanılır: PH3 (fosfin) + SO2 (kükürt dioksit) = H3PO2 (fosfor asit) + S (kükürt). Kükürt dioksit nerede kullanılır? Kükürt dioksit esas olarak sülfürik asit üretmek için kullanılır. Ayrıca düşük alkollü içeceklerin (şarap ve diğer orta fiyatlı içecekler) üretiminde de kullanılır. Bu gazın çeşitli mikroorganizmaları öldürme özelliği nedeniyle fumigasyon amacıyla kullanılır. depolar ve sebze depolama. Ayrıca yün, ipek ve samanın (klorla ağartılamayan malzemeler) ağartılmasında kükürt oksit kullanılır. Laboratuvarlarda kükürt dioksit çözücü olarak ve çeşitli kükürt dioksit tuzları elde etmek için kullanılır. Fizyolojik etkiler Kükürt dioksit güçlü toksik özelliklere sahiptir. Zehirlenme belirtileri öksürük, burun akıntısı, ses kısıklığı, ağızda tuhaf bir tat ve şiddetli boğaz ağrısıdır. Yüksek konsantrasyonda kükürt dioksit solunduğunda yutma ve boğulma güçlüğü, konuşma bozukluğu, bulantı ve kusma meydana gelir ve akut akciğer ödemi gelişebilir. Kükürt dioksitin MPC'si: Sülfür dioksite duyarlılık bireyler, bitkiler ve hayvanlar arasında değişir. Örneğin ağaçlar arasında en dayanıklı olanlar meşe ve huş, en az dayanıklı olanlar ise ladin ve çamdır. Bu yazımızda kükürt oksitin ne olduğu hakkında bilgi bulacaksınız. Temel kimyasal ve fiziksel özellikleri, mevcut formları, hazırlanma yöntemleri ve birbirlerinden farklılıkları ele alınacaktır. Bu oksidin çeşitli formlarındaki uygulamaları ve biyolojik rolünden de bahsedilecektir. Madde nedirKükürt oksit, basit maddelerin, kükürt ve oksijenin bir bileşiğidir. S değerlik derecesine göre farklılık gösteren üç kükürt oksit formu vardır: SO (kükürt monoksit, kükürt monoksit), SO2 (kükürt dioksit veya kükürt dioksit) ve SO3 (kükürt trioksit veya anhidrit). Kükürt oksitlerin listelenen tüm çeşitleri benzer kimyasal ve fiziksel özelliklere sahiptir. Kükürt monoksit hakkında genel bilgiİki değerlikli kükürt monoksit veya başka türlü kükürt monoksit, iki basit elementten (kükürt ve oksijen) oluşan inorganik bir maddedir. Formül - SO. Normal şartlarda renksiz bir gazdır ancak keskin ve kendine özgü bir kokusu vardır. Sulu bir çözelti ile reaksiyona girer. Dünya atmosferinde oldukça nadir bulunan bir bileşik. Sıcaklığa karşı kararsızdır ve dimerik formda bulunur - S 2 O 2. Bazen reaksiyonun bir sonucu olarak oksijenle etkileşime girerek kükürt dioksit oluşturabilir. Tuz oluşturmaz.
Kükürt oksit (2) genellikle kükürdün yakılması veya anhidritinin ayrıştırılmasıyla elde edilir:
Madde suda çözünür. Sonuç olarak kükürt oksit, tiyosülfürik asit oluşturur:
Kükürt dioksit hakkında genel verilerKükürt oksit, kükürt oksitlerin başka bir şeklidir. kimyasal formül SO2. Hoş olmayan özel bir kokusu vardır ve renksizdir. Basınca maruz kaldığında oda sıcaklığında tutuşabilir. Suda çözündüğünde kararsız sülfürik asit oluşturur. Etanol ve sülfürik asit çözeltilerinde çözünebilir. Volkanik gazın bir bileşenidir.
Endüstride kükürt yakılarak veya sülfürlerinin kavrulmasıyla elde edilir:
Laboratuvarlarda, kural olarak, S02, sülfitler ve hidrosülfitler kullanılarak, bunları güçlü asitlere maruz bırakarak ve ayrıca düşük aktivite derecesine sahip metallerin konsantre H2S04'e maruz bırakılmasıyla elde edilir. Diğer kükürt oksitler gibi SO2 de asidik bir oksittir. Alkalilerle etkileşime girerek çeşitli sülfitler oluşturur, suyla reaksiyona girerek sülfürik asit oluşturur. SO2 son derece aktiftir ve bu, kükürt oksidin oksidasyon durumunun arttığı indirgeyici özelliklerinde açıkça ifade edilir. Güçlü bir indirgeyici maddeye maruz kaldığında oksitleyici özellikler sergileyebilir. Sonuncusu karakteristik özellik hipofosfor asit üretimi için veya metalurji alanında gazlardan S'yi ayırmak için kullanılır. Sülfür oksit (4), insanlar tarafından sülfürik asit veya tuzlarını üretmek için yaygın olarak kullanılır - bu onun ana uygulama alanıdır. Ayrıca şarap yapımı süreçlerine katılır ve burada koruyucu olarak görev yapar (E220); mikroorganizmaları yok ettiği için bazen sebze depolarında ve depolarda turşu yapmak için kullanılır. Klorla ağartılamayan malzemeler kükürt oksitle işlemden geçirilir.
SO2 oldukça toksik bir bileşiktir. Zehirlenmeyi gösteren karakteristik semptomlar öksürük, genellikle burun akıntısı şeklinde nefes alma sorunları, ses kısıklığı, alışılmadık tat ve boğaz ağrısıdır. Bu gazın solunması kişide boğulma, konuşma yeteneğinin bozulması, kusma, yutma güçlüğü ve akciğer ödemine neden olabilir. akut form. Bu maddenin çalışma alanında izin verilen maksimum konsantrasyonu 10 mg/m3'tür. Ancak farklı insanların vücutları kükürt dioksite karşı farklı hassasiyet gösterebilir. Sülfürik anhidrit hakkında genel bilgiKükürt gazı veya adlandırıldığı şekliyle sülfürik anhidrit, SO3 kimyasal formülüne sahip daha yüksek bir kükürt oksittir. Boğucu bir kokuya sahip sıvı, kullanıldığında oldukça uçucudur. standart koşullar. 16,9 °C ve altındaki sıcaklıklarda katılaşma, katı modifikasyonlarından kristalli karışımlar oluşturma yeteneğine sahiptir.
Daha yüksek oksitin detaylı analiziSO 2, yüksek sıcaklıkların etkisi altında hava tarafından oksitlendiğinde, gerekli bir durumörneğin V205, Fe203, NaV03 veya Pt gibi bir katalizörün varlığıdır. Sülfatların termal ayrışması veya ozon ve SO2'nin etkileşimi:
SO2'nin NO2 ile oksidasyonu:
Fiziksel niteliksel özellikler şunları içerir: gaz halindeki düz bir yapının, trigonal tipin ve D3 h simetrisinin varlığı; gazdan kristale veya sıvıya geçiş sırasında, döngüsel nitelikte bir trimer ve bir zikzak zinciri oluşturur ve kovalent polar bağ. Katı formda S03, alfa, beta, gama ve sigma formlarında bulunur ve buna bağlı olarak farklı erime noktalarına, polimerizasyon derecelerine ve çeşitli kristal formlara sahiptir. Bu kadar çok sayıda SO3 türünün varlığı, donör-alıcı tipi bağların oluşmasından kaynaklanmaktadır. Sülfür anhidrürün özellikleri, birçok niteliğini içerir; başlıcaları şunlardır: Bazlar ve oksitlerle etkileşime girme yeteneği:
Daha yüksek kükürt oksit SO3 oldukça yüksek bir aktiviteye sahiptir ve su ile etkileşime girerek sülfürik asit oluşturur:
Hidrojen klorür ile reaksiyona girer ve klorosülfat asidi oluşturur:
Kükürt oksit, güçlü oksitleyici özelliklerin tezahürü ile karakterize edilir. Sülfürik anhidrit, sülfürik asit üretiminde kullanılır. Küçük bir miktarı vücuda salınır. çevre kükürt bombaları kullanırken. Islak yüzeyle etkileşime girdikten sonra sülfürik asit oluşturan SO3, mantarlar gibi çeşitli tehlikeli organizmaları yok eder. ÖzetlemekKükürt oksit farklı şekillerde bulunabilir toplanma durumları sıvıdan katı forma. Doğada nadir bulunur, ancak endüstride ve kullanılabileceği alanlarda onu elde etmenin pek çok yolu vardır. Oksitin kendisi, farklı derecelerde değerlik sergilediği üç forma sahiptir. Oldukça toksik olabilir ve ciddi sağlık sorunlarına neden olabilir. Sülfürün +4 oksidasyon durumu oldukça kararlıdır ve SHal 4 tetrahalidler, SOHal 2 oksodihalidler, SO 2 dioksit ve bunlara karşılık gelen anyonlarda kendini gösterir. Sülfür dioksit ve sülfürlü asidin özelliklerini tanıyacağız. 1.11.1. Kükürt (IV) oksit So2 molekülünün yapısıSO 2 molekülünün yapısı ozon molekülünün yapısına benzer. Sülfür atomu sp2 hibridizasyonu durumundadır, yörüngelerin şekli düzenli bir üçgendir ve molekülün şekli açısaldır. Kükürt atomunun yalnız bir elektron çifti vardır. S–O bağ uzunluğu 0,143 nm ve bağ açısı 119,5°'dir. Yapı aşağıdaki rezonans yapılarına karşılık gelir: Ozondan farklı olarak S-O bağının çokluğu 2'dir, yani asıl katkı birinci rezonans yapısından sağlanır. Molekül yüksek termal stabilite ile karakterize edilir. Fiziksel özelliklerNormal koşullar altında kükürt dioksit veya kükürt dioksit, keskin, boğucu bir kokuya sahip, erime noktası -75 °C, kaynama noktası -10 °C olan renksiz bir gazdır. Suda yüksek oranda çözünür; 20°C'de 1 hacim suda 40 hacim kükürt dioksit çözünür. Zehirli gaz. Kükürt (IV) oksidin kimyasal özellikleriKükürt dioksit oldukça reaktiftir. Kükürt dioksit asidik bir oksittir. Hidrat oluşturmak için suda oldukça çözünür. Ayrıca suyla kısmen reaksiyona girerek bireysel formda izole edilmeyen zayıf sülfürik asit oluşturur: S02 + H20 = H2S03 = H + + HSO3 - = 2H + + S03 2- . Ayrışma sonucunda protonlar oluştuğundan çözelti asidik bir ortama sahip olur. Sülfür dioksit gazı bir sodyum hidroksit çözeltisinden geçirildiğinde sodyum sülfit oluşur. Sodyum sülfit, aşırı kükürt dioksit ile reaksiyona girerek sodyum hidrosülfit oluşturur: 2NaOH + S02 = Na2S03 + H20; Kükürt dioksit redoks ikiliğiyle karakterize edilir; örneğin indirgeyici özellikler sergiler ve bromlu suyun rengini giderir: S02 + Br2 + 2H20 = H2S04 + 2HBr ve potasyum permanganat çözeltisi: 5SO2 + 2KMnO4 + 2H20 = 2KНSO4 + 2MnS04 + H2S04. oksijenle sülfürik anhidrite oksitlenir: 2SO2 + Ö2 = 2SO3. Güçlü indirgeyici maddelerle etkileşime girdiğinde oksitleyici özellikler sergiler, örneğin: S02 + 2CO = S + 2CO2 (500 °C'de, Al203 varlığında); S02 + 2H2 = S + 2H20. Sülfür oksit (IV) hazırlanmasıKükürtün havada yanması S + Ö2 = SO2. Sülfür oksidasyonu 4FeS2 + 11O2 = 2Fe203 + 8SO2. Güçlü asitlerin metal sülfitler üzerindeki etkisi Na2S03 + 2H2S04 = 2NaHSO4 + H20 + S02. 1.11.2. Sülfürik asit ve tuzlarıSülfür dioksit suda çözündüğünde zayıf sülfürlü asit oluşur, çözünmüş SO2'nin büyük kısmı soğuduktan sonra hidratlanmış SO2 ·H20 formundadır, kristalin hidrat da açığa çıkar, çözünmüş SO2'nin yalnızca küçük bir kısmı; sülfürik asit molekülleri sülfit ve hidrosülfit iyonlarına ayrışır. Serbest durumda asit açığa çıkmaz. Dibazik olduğundan iki tür tuz oluşturur: orta - sülfitler ve asidik - hidrosülfitler. Suda yalnızca alkali metallerin sülfitleri ve alkali ve alkali toprak metallerinin hidrosülfitleri çözünür. Hidrojen sülfür – H2S Kükürt bileşikleri -2, +4, +6. Sülfürlere, sülfitlere, sülfatlara kalitatif reaksiyonlar. Etkileşim üzerine makbuz: 1. t – 300 0'da kükürtlü hidrojen 2. Mineral asit sülfürlere etki ederken: Na 2 S+2HCl =2 NaCl+H 2 S çürük yumurta kokusuna sahip, zehirli, havadan ağır, suda çözünerek zayıf hidrojen sülfür asit oluşturan renksiz bir gaz. Kimyasal özellikler Asit-baz özellikleri 1. Sudaki bir hidrojen sülfit çözeltisi - hidrosülfit asit - zayıf bir dibazik asittir, bu nedenle adım adım ayrışır: H2S ↔HS - + H + HS - ↔ H - + S 2- 2. Hidrojen sülfür asit genel özellikler asitler, metallerle, bazik oksitlerle, bazlarla, tuzlarla reaksiyona girer: H 2 S + Ca = CaS + H 2 H 2 S + CaO = CaS + H 2 O H2S + 2NaOH = Na2S + 2H20 H 2 S + CuSO 4 = CuS↓ + H 2 SO 4 Tüm asit tuzları - hidrosülfitler - suda oldukça çözünür. Normal tuzlar - sülfürler - suda farklı şekillerde çözünür: alkali ve alkali toprak metallerinin sülfürleri oldukça çözünür, diğer metallerin sülfürleri suda çözünmez ve bakır, kurşun, cıva ve diğer bazı ağır metallerin sülfürleri suda bile çözünmez. asitler (nitrik asit hariç) CuS+4HNO 3 =Cu(NO 3) 2 +3S+2NO+2H 2 O Çözünür sülfitler anyonda hidrolize uğrar. Na 2 S ↔ 2Na + + S 2- S 2- +HOH ↔HS - +OH - Na 2 S + H 2 O ↔ NaHS + NaOH Hidrosülfit asit ve onun çözünür tuzlarına (yani sülfür iyonu S2-'ye) yönelik kalitatif bir reaksiyon, bunların çözünür kurşun tuzları ile etkileşimidir, bu da siyah bir PbS çökeltisinin oluşmasıyla sonuçlanır. Na 2 S + Pb(NO 3) 2 = 2NaNO 3 + PbS↓ Pb 2+ + S 2- = PbS↓
Yalnızca onarıcı özellikleri gösterir, çünkü kükürt atomu en düşük oksidasyon durumuna sahiptir -2 1. oksijen ile a) dezavantajlı 2H 2 S -2 +O 2 0 = S 0 +2H 2 O -2 b) aşırı oksijenle 2H 2 S+3O 2 =2SO 2 +2H 2 O 2. halojenli (bromlu suyun renginin değişmesi) H 2 S -2 +Br 2 =S 0 +2HBr -1 3. kons. HNO3 H 2 S+2HNO 3 (k) = S+2NO 2 +2H 2 O b) güçlü oksitleyici maddelerle (asitli ortamda KMnO 4, K 2 CrO 4) 2KMnO 4 +3H 2 SO 4 +5H 2 S = 5S+2MnSO 4 +K 2 SO 4 +8H 2 O c) hidrosülfit asit, yalnızca güçlü oksitleyici maddelerle değil, aynı zamanda daha zayıf olanlarla, örneğin demir (III) tuzları, sülfürik asit vb. ile de oksitlenir. 2FeCl3 + H2S = 2FeCl2 + S + 2HCl H2S03 + 2H2S = 3S + 3H20 Fiş 1. kükürtün oksijende yanması. 2. O2 fazlalığında hidrojen sülfürün yanması 2H 2 S+3O 2 = 2SO 2 +2H 2 O 3. sülfür oksidasyonu 2CuS+3O2 = 2SO2 +2CuO 4. Sülfitlerin asitlerle etkileşimi Na 2 SO 3 +H 2 SO 4 =Na 2 SO 4 +SO 2 +H 2 O 5. (H 2) sonrası aktivite serisindeki metallerin kons. H2SO4 Cu+2H 2 SO 4 = CuSO 4 + SO 2 +2H 2 O Fiziksel özellikler Gaz, renksiz, boğucu yanık kükürt kokusuna sahip, zehirli, havadan 2 kat daha ağır, suda oldukça çözünür (oda sıcaklığında, bir hacimde yaklaşık 40 hacim gaz çözünür). Kimyasal özellikler: Asit-baz özellikleri SO2 tipik bir asidik oksittir. 1. alkalilerle iki tür tuz oluşturur: sülfitler ve hidrosülfitler 2KOH+SO2 = K2SO3 +H2O KOH+S02 = KHSO3 +H20 2.bazik oksitlerle K 2 O+S02 = K 2 SO 3 3. Su ile zayıf sülfürik asit oluşur H 2 O+S02 = H 2 SO 3 Sülfürik asit sadece çözelti halinde bulunur ve zayıf bir asittir. Asitlerin tüm genel özelliklerine sahiptir. 4. sülfit iyonuna kalitatif reaksiyon - SO3 2 - mineral asitlerin etkisi Na 2 SO 3 +2HCl= 2Na 2 Cl+SO 2 +H 2 O yanmış kükürt kokusu Redoks özellikleri ORR'de hem oksitleyici hem de indirgeyici bir madde olabilir, çünkü SO2'deki kükürt atomunun ara oksidasyon durumu +4'tür. Oksitleyici bir madde olarak: S02 + 2H2S = 3S + 2H2S İndirgeyici ajan olarak: 2SO2 +O2 = 2SO3 Cl 2 +S02 +2H 2 O = H 2 SO 4 +2HCl 2KMnO 4 +5SO 2 +2H 2 O = K 2 SO 4 +2H 2 SO 4 +2MnSO 4 Sülfür oksit (VI) SO3 (sülfürik anhidrit) Fiş: Kükürt dioksitin oksidasyonu 2SO 2 + O 2 = 2SO 3 ( t 0 kat) Fiziksel özellikler Renksiz bir sıvı, 17 0 C'nin altındaki sıcaklıklarda beyaz kristal bir kütleye dönüşür. Termal olarak kararsız bileşik, 700 0 C'de tamamen ayrışır. Suda ve susuz sülfürik asitte yüksek oranda çözünür ve onunla reaksiyona girerek oleum oluşturur. S03 + H2S04 = H2S207 Kimyasal özellikler Asit-baz özellikleri Tipik asit oksit. 1. alkalilerle iki tür tuz oluşturur: sülfatlar ve hidrosülfatlar 2KOH+S03 = K2S04 +H20 KOH+S03 = KHSO4 +H20 2.bazik oksitlerle CaO+S02 = CaS04 3. su ile H 2 Ö + SO 3 = H 2 SO 4 Redoks özellikleri Kükürt oksit (VI) güçlü bir oksitleyici maddedir ve genellikle SO2'ye indirgenir. 3SO3 + H2S = 4SO2 + H2O Sülfürik asit H2S04 Sülfürik asitin hazırlanması Endüstride asit temas yöntemiyle üretilir: 1. pirit ateşlemesi 4FeS2 +11O2 = 2Fe203 + 8SO2 2. SO2'nin SO3'e oksidasyonu 2SO 2 + O 2 = 2SO 3 ( t 0 kat) 3. SO3'ün sülfürik asitte çözünmesi N S03 + H2S04 = H2S04 ∙ N SO 3 (oleum) H2SO4∙ N S03 + H20 = H2S04 Fiziksel özellikler H2SO4 ağır yağlı bir sıvıdır, kokusuz ve renksiz, higroskopiktir. Su ile her oranda karışır; konsantre sülfürik asit suda çözündüğünde büyük miktarda ısı açığa çıkar, bu nedenle suya dikkatli bir şekilde dökülmelidir, tersi yapılmamalıdır (önce su, sonra asit, aksi takdirde büyük sorun olur). ) H2S04 içeriği% 70'ten az olan sudaki bir sülfürik asit çözeltisine genellikle% 70'den fazla konsantre olan seyreltik sülfürik asit denir. Kimyasal özellikler Asit-baz Seyreltik sülfürik asit, güçlü asitlerin tüm karakteristik özelliklerini gösterir. Sulu çözeltide ayrışır: H 2 SO 4 ↔ 2H + + SO 4 2- 1. bazik oksitlerle MgO + H2S04 = MgS04 + H20 2. gerekçeli 2NaOH +H2S04 = Na2S04 + 2H20 3. tuzlarla BaCl2 + H2S04 = BaS04 ↓ + 2HCl Ba 2+ + SO 4 2- = BaSO 4 ↓ (beyaz çökelti) Sülfat iyonu SO4'e kalitatif reaksiyon 2- Daha fazlası sayesinde yüksek sıcaklık diğer asitlerle karşılaştırıldığında kaynatma, sülfürik asit ısıtıldığında onları tuzlardan uzaklaştırır: NaCl + H2S04 = HCl + NaHSO4 Redoks özellikleri Seyreltik H2S04'te oksitleyici maddeler H+ iyonlarıdır ve konsantre H2S04'te oksitleyici maddeler S042 sülfat iyonlarıdır. Hidrojene kadar aktivite serisindeki metaller seyreltik sülfürik asitte çözünür, sülfatlar oluşur ve hidrojen açığa çıkar Zn + H2S04 = ZnS04 + H2 Konsantre sülfürik asit, özellikle ısıtıldığında kuvvetli bir oksitleyici maddedir. Birçok metali, metal olmayanları, inorganik ve organik maddeleri oksitler. H 2 SO 4 (k) oksitleyici ajan S +6 Daha aktif metallerle sülfürik asit, konsantrasyona bağlı olarak çeşitli ürünlere indirgenebilir. Zn + 2H 2 SO 4 = ZnS04 + SO 2 + 2H 2 O 3Zn + 4H2S04 = 3ZnS04 + S + 4H2O 4Zn + 5H2S04 = 4ZnS04 + H2S + 4H2O Konsantre sülfürik asit, bazı metal olmayan maddeleri (sülfür, karbon, fosfor vb.) oksitleyerek sülfür okside indirger (IV) S + 2H2S04 = 3SO2 + 2H20 C + 2H2S04 = 2SO2 + C02 + 2H20 Bazı karmaşık maddelerle etkileşim H 2 SO 4 + 8HI = 4I 2 + H 2 S + 4 H 2 O H 2 SO 4 + 2HBr = Br 2 + SO 2 + 2H 2 O Sülfürik asit tuzları 2 tür tuz: sülfatlar ve hidrosülfatlar Sülfürik asit tuzları, tuzların tüm genel özelliklerine sahiptir. Isı ile ilişkileri özeldir. Aktif metallerin sülfatları (Na, K, Ba) 1000 0 C'nin üzerine ısıtıldığında bile ayrışmaz, daha az aktif metallerin (Al, Fe, Cu) tuzları hafif ısıtmayla bile ayrışır |
Popüler:
Fırında pişmiş somon
|
Yeni
- Çocuğu olan bir dul kadını kovmak mümkün mü? Küçük çocuğu olan bir dul kadını kovmak mümkün mü?
- Rektal mukozadaki hasarın tedavisi Neredeyse rektumun yırtılması yaşandı
- Gezegen Üçüncü Dünya Savaşıyla mı karşı karşıya?
- Sodom ve Gomorra'nın Tarihi
- Kutsal Ruh - neden ona ihtiyacımız var Hıristiyan Biliminde kutsal ruh kimdir?
- Yapay gökyüzü aydınlatma bölgeleri
- Baykonur Kozmodromu - dünyadaki ilk kozmodrom
- Transuranyum elementleri Geçiş metalleri neden kötüdür?
- Uzay asansörü ve nanoteknoloji Yörünge asansörü
- Mümkün olan görev: Rusya'ya Mars keşif gezisinde kilit bir rol verildi