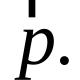1
/
5
Въпреки това, точно и по-късно напълно потвърдено разбиране на феномена на валентността е предложено през 1852 г. от химика Едуард Франкланд в работа, в която той събира и преосмисля всички теории и предположения, съществуващи по това време в това отношение. Чрез наблюдение на способността за насищане на различни метали и сравняване на състава на органичните производни на металите със състава на не органични съединения, Франкланд въведе концепцията за " свързваща сила» ( свързващо тегло), като по този начин се полагат основите на доктрината за валентността. Въпреки че Франкланд установи някои конкретни закони, идеите му не бяха развити.
Фридрих Август Кекуле играе решаваща роля в създаването на теорията за валентността. През 1857 г. той показа, че въглеродът е четириосновен (тетраатомен) елемент и най-простото му съединение е метан CH4. Уверен в истинността на идеите си за валентността на атомите, Кекуле ги въвежда в своя учебник по органична химия: основността, според автора, е основно свойство на атома, свойство, постоянно и непроменливо като атомното тегло. През 1858 г. възгледи, почти съвпадащи с идеите на Кекуле, са изразени в статията „ За новата химическа теория» Арчибалд Скот Купър.
Три години по-късно, през септември 1861 г., А. М. Бутлеров прави най-важните допълнения към теорията на валентността. Той направи ясно разграничение между свободен атом и атом, който е влязъл в комбинация с друг, когато неговият афинитет " свързва и отива към нова униформа
" Бутлеров въведе концепцията за пълното използване на силите на афинитета и „ афинитетно напрежение", тоест енергийната нееквивалентност на връзките, която се дължи на взаимното влияние на атомите в молекулата. В резултат на това взаимно влияние атомите в зависимост от структурната си среда придобиват разл „химическо значение" Теорията на Бутлеров позволи да се обяснят много експериментални факти относно изомерията на органичните съединения и тяхната реактивност.
Огромно предимство на теорията на валентността беше възможността за визуално представяне на молекулата. През 1860г. се появяват първите молекулярни модели. Още през 1864 г. А. Браун предложи да се използват структурни формули под формата на кръгове със символи на елементи, поставени в тях, свързани с линии, показващи химическата връзка между атомите; броят на линиите съответстваше на валентността на атома. През 1865 г. А. фон Хофман демонстрира първите модели с топка и пръчка, в които топките за крокет играят ролята на атоми. През 1866 г. в учебника на Кекуле се появяват чертежи на стереохимични модели, в които въглеродният атом има тетраедрична конфигурация.
Първоначално валентността на водородния атом се приема като единица за валентност. Валентността на друг елемент може да бъде изразена чрез броя на водородните атоми, които добавят към себе си или заместват един атом на този друг елемент. Валентността, определена по този начин, се нарича валентност във водородните съединения или водородна валентност: например в съединенията HCl, H 2 O, NH 3, CH 4 водородната валентност на хлора е една, кислорода - две, азота - три, въглерод - четири.
Валентността на кислорода обикновено е равна на две. Следователно, знаейки състава или формулата на кислородно съединение на даден елемент, човек може да определи неговата валентност като два пъти броя на кислородните атоми, които могат да прикрепят един атом на даден елемент. Определената по този начин валентност се нарича валентност на елемента в кислородните съединения или кислородна валентност: по този начин в съединенията K 2 O, CO, N 2 O 3, SiO 2, SO 3 кислородната валентност на калия е една, въглерод - два, азот - три, силиций - четири, сяра - шест.
За повечето елементи стойностите на валентността във водородните и кислородните съединения са различни: например валентността на сярата във водорода е две (H 2 S), а в кислорода шест (SO 3). В допълнение, повечето елементи проявяват различни валентности в различните си съединения [някои елементи може да нямат нито хидриди, нито оксиди]. Например въглеродът образува два оксида с кислорода: въглероден оксид CO и въглероден диоксид CO 2 . Във въглеродния оксид валентността на въглерода е две, а във въглеродния диоксид е четири (някои елементи също могат да образуват пероксиди). От разгледаните примери следва, че по правило е невъзможно да се характеризира валентността на даден елемент с едно число и/или метод.
Съвременни представи за валентността
От появата на теорията за химическото свързване понятието "валентност" е претърпяло значителна еволюция. Понастоящем той няма строго научно тълкуване, поради което е почти напълно изместен от научния речник и се използва главно за методически цели.
По принцип валентността на химичния елемент обикновено се разбира като способността на неговите свободни атоми (в по-тесен смисъл, мярка за неговата способност) да образуват определен брой ковалентни връзки. В съединения с ковалентни връзки валентността на атомите се определя от броя на образуваните двуелектронни двуцентрови връзки. Именно този подход е възприет в теорията за локализираните валентни връзки, предложена през 1927 г. от В. Хайтлер и Ф. Лондон. Очевидно, ако един атом има пнесдвоени електрони и мнесподелени електронни двойки, тогава този атом може да се образува n+mковалентни връзки с други атоми. При оценката на максималната валентност трябва да се изхожда от електронната конфигурация на хипотетичната, т.нар. „възбудено” (валентно) състояние. Например, максималната валентност на атом на бор, въглерод и азот е 4 (например в −, CH 4 и +), фосфор - 5 (PCl 5), сяра - 6 (H 2 SO 4), хлор - 7 (С12О7).
Броят на връзките, които един атом може да образува, е равен на броя на неговите несдвоени електрони, използвани за образуване на общи електронни двойки (молекулни двуелектронни облаци). Ковалентна връзка може да се образува и чрез донорно-акцепторен механизъм. Освен това и в двата случая не се взема предвид полярността на образуваните връзки и следователно валентността няма знак - тя не може да бъде нито положителна, нито отрицателна, за разлика от степента на окисление(N 2, NO 2, NH 3 и +).
В допълнение към валентността на водорода и кислорода, способността на атомите на даден елемент да се комбинират един с друг или с атоми на други елементи в редица случаи може да бъде изразена [често идентифицирана] по други начини: например, степен на окисление на елемента (условният заряд на атома при предположението, че веществото се състои от йони), ковалентност (броят на химичните връзки, образувани от атом на даден елемент, включително с едноименния елемент; виж по-долу ), координационно число на атом (броят на атомите, непосредствено заобикалящи даден атом) и т.н. Тези характеристики могат да бъдат близки и дори да съвпадат количествено, но по никакъв начин не са идентични една с друга. Например, в изоелектронните молекули на азота N2, въглеродния оксид CO и цианидния йон CN− се реализира тройна връзка (т.е. валентността на всеки атом е 3), но степента на окисление на елементите е съответно 0 , +2, −2, +2 и −3. В молекулата на етана (вижте фигурата) въглеродът е четиривалентен, както в повечето органични съединения, докато степента на окисление е -3.
Това е особено вярно за молекули с делокализирани химични връзки, например в азотната киселина степента на окисление на азота е +5, докато азотът не може да има валентност, по-висока от 4. Известен от много училищни учебнициправило - „Максимум валентностелемент е числено равен на номера на групата в периодичната таблица" - отнася се единствено до степента на окисление. Понятията „постоянна валентност“ и „променлива валентност“ също се отнасят основно до степента на окисление.
Ковалентностелемент (мярка за валентните способности на елементите; капацитет на насищане). общ бройнесдвоени електрони [валентни електронни двойки] както в нормалното, така и във възбуденото състояние на атома, или, с други думи, броят на ковалентните връзки, образувани от атома (въглеродът 2s 2 2p 2 II е ковалентен, а във възбуденото състояние C* 2s 1 2p 3 - IV -ковалентен; по този начин в CO и CO 2 валентността е II или IV, а ковалентността - II и/или IV). Така ковалентността на азота в молекулите N 2 , NH 3 , Al≡N и цианамид Ca=N-C≡N е три, ковалентността на кислорода в молекулите H 2 O и CO 2 е две, ковалентността на въглерода в молекулите CH 4 , CO 2 и кристал (диамант) - четири.
В класическата и/или постквантовата химична концепция броят на оптичните (валентни) електрони при дадена енергия на възбуждане може да се определи от електронните абсорбционни спектри на двуатомни молекули. Съгласно този метод, реципрочната стойност на тангенса на наклона на корелационната права линия/правите линии (със съответните стойности на молекулни електронни термини, които се образуват от относителни суми на атомни) съответства на броя двойки от валентни електрони, тоест валентност в нейния класически смисъл.
Между валентност [стехиометрична] в тази връзка, моларната маса на неговите атоми и неговата еквивалентна маса има проста връзка, която пряко следва от атомната теория и дефиницията на понятието „еквивалентна маса CO -“. валентност, тъй като повечето неорганични вещества имат немолекулна структура, докато повечето органични вещества имат молекулярна структура. Тези две понятия не могат да бъдат идентифицирани, дори и да съвпадат числено. Широко се използва и терминът „валентни електрони“, тоест най-слабо свързаните с ядрото на атома, най-често външните електрони.
Въз основа на валентността на елементите могат да се съставят истински формули на съединения и, обратно, въз основа на истински формули могат да се определят валентностите на елементите в дадени съединения. В този случай е необходимо да се придържаме към принципа, че произведението на валентността на един елемент по броя на неговите атоми е равно на произведението на валентността на втория елемент по броя на неговите атоми. Така че, за да създадете формулата на азотен оксид (III), трябва да напишете над символа на валентността на елементите N I I I (\displaystyle (\stackrel (III)(\mbox(N)))) O I I (\displaystyle (\stackrel (II)(\mbox(O)))). След като определи най-малката общ знаменатели разделяйки го на съответните валенции, получаваме атомното съотношение на азот към кислород, а именно 2: 3. Следователно формулата на азотния оксид (III) съответства N + 3 2 O − 2 3 (\displaystyle (\stackrel (+3)(\mbox(N)))_(2)(\stackrel (-2)(\mbox(O)))_(3)). За да определите валентността, направете същото в обратен ред.
Химическата формула отразява състава (структурата) на химично съединение или просто вещество. Например H 2 O - два водородни атома са свързани с кислороден атом. Химичните формули също съдържат известна информация за структурата на веществото: например Fe(OH) 3, Al 2 (SO 4) 3 - тези формули показват някои стабилни групи (OH, SO 4), които са част от веществото - неговата молекула, формула или структурна единица (FU или SE).
Молекулна формулапоказва броя на атомите на всеки елемент в молекулата. Молекулната формула описва само вещества с молекулярна структура (газове, течности и някои твърди вещества). Съставът на вещество с атомна или йонна структура може да бъде описан само със символи на формулни единици.
Формулни единиципосочете най-простата връзка между броя на атомите различни елементив материята. Например, формулната единица на бензена е CH, молекулната формула е C 6 H 6.
Структурна (графична) формулапоказва реда на свързване на атомите в молекула (както и в PU и CE) и броя на връзките между атомите.
Разглеждането на такива формули доведе до идеята за валентност(valentia - сила) - като способност на атом на даден елемент да прикрепя към себе си определен брой други атоми. Могат да се разграничат три вида валентност: стехиометрична (включително степен на окисление), структурна и електронна.
Стехиометрична валентност.Количественият подход за определяне на валентността се оказа възможен след установяването на понятието „еквивалент“ и неговото определение според закона на еквивалентите. Въз основа на тези концепции можем да въведем идея за стехиометрична валентносте броят на еквивалентите, които даден атом може да прикрепи към себе си, или е броят на еквивалентите в атом. Еквивалентите се определят от броя на водородните атоми, тогава V сх всъщност означава броя на водородните атоми (или еквивалентни на него частици), с които даден атом взаимодейства.
V stx = Z B или V stx = .
(1.1)
Например, в SO 3 ( S= +6), Z B (S) е равно на 6 V stx (S) = 6. Еквивалентът на водород е 1, така че за елементите в съединенията по-долу Z B (Cl) = 1, Z B (O) = 2, Z B (N) = 3 и Z B (C) = 4.Числова стойност
Стехиометричната валентност обикновено се обозначава с римски цифри:
I I I II III I IV I
В случаите, когато даден елемент не се свързва с водород, валентността на търсения елемент се определя от елемента, чиято валентност е известна. Най-често се намира с помощта на кислород, тъй като неговата валентност в съединенията обикновено е равна на две. Например във връзки:
II II III II IV II
CaO Al 2 O 3 CO 2.
При определяне на стехиометричната валентност на елемент, използвайки формулата на бинарно съединение, трябва да се помни, че общата валентност на всички атоми на един елемент трябва да бъде равна на общата валентност на всички атоми на друг елемент.
Познавайки валентността на елементите, можете да създадете химичната формула на дадено вещество. Когато съставяте химични формули, можете да следвате следната процедура:
1. Напишете до химичните символи на елементите, които изграждат съединението: KO AlCl AlO ;
2. Тяхната валентност е посочена над символите на химичните елементи:
I II III I III II
3. Използвайки формулираното по-горе правило, определете най-малкото общо кратно на числата, изразяващи стехиометричната валентност на двата елемента (съответно 2, 3 и 6).
Като се раздели най-малкото общо кратно на валентността на съответния елемент, се намират индексите:
I II III I III II
K 2 O AlCl 3 Al 2 O 3 .
Пример 1.Създайте формула за хлорен оксид, като знаете, че хлорът в него е седемвалентен, а кислородът е двувалентен.
Решение.Намираме най-малкото кратно на числата 2 и 7 - то е равно на 14. Разделяйки най-малкото общо кратно на стехиометричната валентност на съответния елемент, намираме индексите: за хлорни атоми 14/7 = 2, за кислородни атоми 14 /2 = 7.
Формулата на оксида е -Cl 2 O 7.
Степен на окислениесъщо така характеризира състава на веществото и е равен на стехиометричната валентност със знак плюс (за метал или по-електроположителен елемент в молекулата) или минус.
= ±V stx. (1.2)
w се дефинира чрез V stx, следователно чрез еквивалент, а това означава, че w(H) = ±1; освен това w на всички други елементи в различни съединения може да се намери експериментално. По-специално, важно е редица елементи винаги или почти винаги да имат постоянни степени на окисление.
Полезно е да запомните следните правила за определяне на степени на окисление.
1. w(H) = ±1 (. w = +1 в H 2 O, HCl; . w = –1 в NaH, CaH 2);
2.
Е(флуор) във всички съединения има w = –1, останалите халогени с метали, водород и други по-електроположителни елементи също имат w = –1.
3. Кислородът в обикновените съединения има. w = –2 (изключения са водородният пероксид и неговите производни – H 2 O 2 или BaO 2, в които кислородът има степен на окисление –1, както и кислородният флуорид OF 2, в който степента на окисление на кислорода е +2 ).
4. Алкалните (Li – Fr) и алкалоземните (Ca – Ra) метали винаги имат степен на окисление, равна на номера на групата, тоест съответно +1 и +2;
5. Al, Ga, In, Sc, Y, La и лантаниди (с изключение на Ce) – w = +3.
6. Най-високата степен на окисление на даден елемент е равна на номера на групата на периодичната система, а най-ниската = (номер на групата - 8). Например най-високото w (S) = +6 в SO 3, най-ниското w = -2 в H 2 S.
7. Степените на окисление на простите вещества се приемат за нула.
8. Степените на окисление на йоните са равни на техните заряди.
9. Степените на окисление на елементите в едно съединение се компенсират взаимно, така че тяхната сума за всички атоми в молекулата или неутралната формулна единица е нула, а за йона това е неговият заряд. Това може да се използва за определяне на неизвестна степен на окисление от известни такива и създаване на формули за многоелементни съединения.
Пример 2.Определете степента на окисление на хрома в солта K 2 CrO 4 и в йона Cr 2 O 7 2 -.
Решение.Приемаме w(K) = +1; w(O) =-2. За структурната единица K 2 CrO 4 имаме:
2 .
(+1) + X + 4 .
(-2) = 0, следователно X = w(Cr) = +6.
За йона Cr 2 O 7 2 - имаме: 2 .
X + 7 .
(-2) =-2, X = w(Cr) = +6.
Тоест степента на окисление на хрома е еднаква и в двата случая.
Пример 3.Определете степента на окисление на фосфора в съединенията P 2 O 3 и PH 3.
Решение.В съединението P 2 O 3 w(O) = -2. Въз основа на факта, че алгебричната сума на степените на окисление на една молекула трябва да бъде равна на нула, намираме степента на окисление на фосфора: 2. X + 3. (-2) = 0, следователно X = w(P) = +3.
В съединението PH 3 w(H) = +1, следователно X + 3.(+1) = 0. X =w(P) =-3.
Пример 4.Напишете формулите на оксидите, които могат да се получат чрез термично разлагане на изброените по-долу хидроксиди:
H2Si03;
Решение. Fe(OH)3;
H3AsO4;
H2WO4;
Cu(OH)2.
H 2 SiO 3 - нека определим степента на окисление на силиция: w(H) = +1, w(O) =-2, следователно: 2. (+1) + X + 3 . (-2) = 0.w(Si) = X = +4. Съставяме формулата на оксида-SiO 2.
Повечето елементи имат няколко степени на окисление.
Нека разгледаме как, използвайки таблицата D.I. Менделеев може да определи основните степени на окисление на елементите.
Стабилни степени на окисление елементи от основните подгрупиможе да се определи по следните правила:
1.
Елементите от групи I-III имат само една степен на окисление - положителна и равна по стойност на номерата на групата (с изключение на талия, който има w = +1 и +3).
За елементи от групи IV-VI, в допълнение към положителната степен на окисление, съответстваща на номера на групата, и отрицателната, равна на разликата между числото 8 и номера на групата, има и междинни степени на окисление, обикновено различни с 2 единици. За група IV степени на окисление са съответно +4, +2, -2, -4; за елементи от група V съответно -3, -1 +3 +5; а за VI група - +6, +4, -2.
3.
Елементите от VII група имат всички степени на окисление от +7 до -1, различаващи се с две единици, т.е. +7, +5, +3, +1 и -1. В групата на халогените се отделя флуор, който няма положителни степени на окисление и в съединения с други елементи съществува само в една степен на окисление -1. (Има няколко халогенни съединения с равномерни степени на окисление: ClO, ClO 2 и т.н.)
Елементите странични подгрупиняма проста връзка между стабилните степени на окисление и номера на групата. За някои елементи от вторичните подгрупи трябва просто да се запомнят стабилните степени на окисление. Тези елементи включват:
Cr (+3 и +6), Mn (+7, +6, +4 и +2), Fe, Co и Ni (+3 и +2), Cu (+2 и +1), Ag (+1) ), Au (+3 и +1), Zn и Cd (+2), Hg (+2 и +1).
За съставяне на формули за три- и многоелементни съединения според степени на окисление е необходимо да се знаят степени на окисление на всички елементи. В този случай броят на атомите на елементите във формулата се определя от условието, че сумата от степените на окисление на всички атоми е равна на заряда на формулната единица (молекула, йон). Например, ако е известно, че незаредената формулна единица съдържа K, Cr и O атоми със степени на окисление, равни съответно на +1, +6 и -2, тогава това условие ще бъде изпълнено от формулите K 2 CrO 4, K 2 Cr 2 O 7, K 2 Cr 3 O 10 и много други; по същия начин този йон със заряд -2, съдържащ Cr +6 и O - 2, ще съответства на формулите CrO 4 2 -, Cr 2 O 7 2 -, Cr 3 O 10 2 -, Cr 4 O 13 2 - и т.н.

3. Електронна валентност V  - броя на химичните връзки, образувани от даден атом.
- броя на химичните връзки, образувани от даден атом.
Например в молекулата H 2 O 2 H ¾ O
V stx (O) = 1, V c.h (O) = 2, V  .(O) = 2
.(O) = 2
Тоест има химични съединения, в които стехиометричните и електронните валентности не съвпадат; те включват, например, комплексни съединения.
Координационните и електронните валентности се разглеждат по-подробно в темите „Химично свързване“ и „Комплексни съединения“.
Инструкции
Таблицата е структура, в която химичните елементи са подредени според техните принципи и закони. Тоест можем да кажем, че това е многоетажна „къща“, в която „живеят“ химичните елементи и всеки от тях има свой собствен собствен апартаментпод определен номер. „Етажите“ са разположени хоризонтално, които могат да бъдат малки или големи. Ако периодът се състои от два реда (както е обозначено с номериране отстрани), тогава такъв период се нарича голям. Ако има само един ред, той се нарича малък.
Таблицата също е разделена на „входове“ - групи, от които има общо осем. Както във всеки вход апартаментите са разположени отляво и отдясно, така и тук химичните елементи са подредени по един и същи начин. Само в този вариант тяхното разположение е неравномерно - от едната страна има повече елементи и тогава те говорят за основната група, от другата са по-малко и това показва, че групата е второстепенна.
Валентността е способността на елементите да се образуват химични връзки. Има константа, която не се променя, и променлива, която се променя различен смисълв зависимост от това от какво вещество е част елементът. Когато определяте валентността с помощта на периодичната таблица, трябва да обърнете внимание на следните характеристики: номера на групата на елементите и нейния тип (т.е. основната или вторичната група). Постоянната валентност в този случай се определя от номера на групата на основната подгрупа. За да разберете стойността на променливата валентност (ако има такава и обикновено y), тогава трябва да извадите номера на групата, в която се намира елементът от 8 (общо 8 - оттам и числото).
Пример № 1. Ако разгледаме елементите от първата група на основната подгрупа (алкална), можем да заключим, че всички те имат валентност, равна на I (Li, Na, K, Rb, Cs, Fr).
Пример № 2. Елементите от втората група на основната подгрупа (алкалоземни метали) съответно имат валентност II (Be, Mg, Ca, Sr, Ba, Ra).
Пример № 3. Ако говорим за неметали, тогава например P (фосфор) е в група V на основната подгрупа. Следователно неговата валентност ще бъде равна на V. Освен това фосфорът има още една стойност на валентност и за да я определите, трябва да изпълните стъпка 8 - номер на елемент. Това означава 8 – 5 (номер на група) = 3. Следователно втората валентност на фосфора е равна на III.
Пример № 4. Халогените са в VII група на главната подгрупа. Това означава, че тяхната валентност ще бъде VII. Въпреки това, като се има предвид, че това са неметали, трябва да извършите аритметична операция: 8 – 7 (номер на група елемент) = 1. Следователно другата валентност е равна на I.
За елементи от вторични подгрупи (и само метали принадлежат към тях) трябва да се помни валентността, особено след като в повечето случаи тя е равна на I, II, по-рядко III. Ще трябва също да запомните валентностите на химичните елементи, които имат повече от две значения.
Видео по темата
Моля, обърнете внимание
Бъдете внимателни, когато идентифицирате метали и неметали. За тази цел символите обикновено се дават в таблицата.
източници:
- как правилно да се произнасят елементите на периодичната таблица
- каква е валентността на фосфора? X
От училище или дори по-рано всеки знае, че всичко наоколо, включително и ние самите, се състои от атоми - най-малките и неделими частици. Благодарение на способността на атомите да се свързват един с друг, разнообразието на нашия свят е огромно. Тази способност на химичните атоми елементобразуват връзки с други атоми се нарича валентност елемент.
Инструкции
На всеки елемент в таблицата е присвоен определен сериен номер (H - 1, Li - 2, Be - 3 и т.н.). Това число съответства на ядрото (броя на протоните в ядрото) и броя на електроните, обикалящи около ядрото. Следователно броят на протоните е равен на броя на електроните, което означава, че при нормални условия атомът е електрически .
Разделянето на седем периода става според броя на енергийните нива на атома. Атомите от първия период имат едностепенна електронна обвивка, втората - двустепенна, третата - тристепенна и т.н. Когато се запълни ново енергийно ниво, започва нов период.
Първите елементи на всеки период се характеризират с атоми, които имат един електрон на външно ниво - това са атоми на алкални метали. Периодите завършват с атоми на благородни газове, които имат външно енергийно ниво, напълно запълнено с електрони: в първия период благородните газове имат 2 електрона, в следващите периоди - 8. Именно поради сходната структура на електронните обвивки, групи от елементи имат сходна физика.
В таблицата Д.И. Менделеев има 8 основни подгрупи. Този брой се определя от максималния възможен брой електрони на енергийно ниво.
В долната част на периодичната таблица лантанидите и актинидите се разграничават като независими серии.
С помощта на таблицата D.I. Менделеев, може да се наблюдава периодичността на следните свойства на елементите: атомен радиус, атомен обем; йонизационен потенциал; сили на електронен афинитет; електроотрицателност на атома; ; физични свойствапотенциални връзки.
Ясно проследима периодичност на подреждането на елементите в таблицата D.I. Менделеев се обяснява рационално с последователния характер на запълване на енергийните нива с електрони.
източници:


 - броя на химичните връзки, образувани от даден атом.
- броя на химичните връзки, образувани от даден атом. .(O) = 2
.(O) = 2