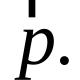Mga seksyon ng site
Pinili ng Editor:
- Mga Panuntunan ng Russian spelling at bantas (1956)
- Posible bang tanggalin ang isang balo na may anak?
- Paggamot ng pinsala sa rectal mucosa Halos dumanas ng pagkalagot ng tumbong
- Nahaharap ba ang planeta sa World War III?
- Kasaysayan ng Sodoma at Gomorra
- Ang Banal na Espiritu - bakit kailangan natin ito Sino ang banal na espiritu sa Christian Science
- Mga artificial sky illumination zone
- Baikonur Cosmodrome - ang unang cosmodrome sa mundo
- Mga elementong transuraniko Bakit masama ang mga transition metal
- Space elevator at nanotechnology Orbital elevator
Advertising
| Sulfur oxide sa kalikasan at buhay ng tao. Sulfur(IV) oxide at sulfurous acid |
|
Karamihan sa sulfur(IV) oxide ay ginagamit upang makagawa ng sulfurous acid. Ginagamit din ang sulfur (IV) oxide upang makakuha ng iba't ibang salts ng sulfurous acid. Ang sulfuric acid ay nagpapakita ng mga acidic na katangian sa mga reaksyon sa mga base at pangunahing oksido. Dahil ang sulfuric acid ay dibasic, ito ay bumubuo ng dalawang serye ng mga asing-gamot: medium - sulfates, halimbawa Na2SO4, at acidic - hydrosulfates, halimbawa NaHSO4. Natutunaw din ito sa ethanol at sulfuric acid. Sa pagkakaroon ng malakas na mga ahente ng pagbabawas, ang SO2 ay may kakayahang magpakita ng mga katangian ng oxidizing. Ang pagbagsak ng sulfuric acid aerosol mula sa mga usok ng mga halamang kemikal ay mas madalas na nakikita sa mababang ulap at mataas na kahalumigmigan hangin.
Ang sulfur dioxide ay umabot sa pinakamataas na konsentrasyon nito sa hilagang hemisphere, lalo na sa teritoryo ng USA, Europe, China, European na bahagi ng Russia at Ukraine. Ang pagbuo ng isang puting precipitate ng BaSO4 (hindi matutunaw sa mga acid) ay ginagamit upang makilala ang sulfuric acid at mga natutunaw na sulfate. Ang sulfurous acid ay umiiral lamang sa solusyon. Ang sulfur trioxide ay nagpapakita ng mga acidic na katangian. Ang reaksyong ito ay ginagamit upang makagawa ng pinakamahalagang produkto ng industriya ng kemikal - sulfuric acid. Dahil ang asupre sa sulfur trioxide ay may pinakamataas na antas oksihenasyon, pagkatapos ay ang sulfur(VI) oxide ay nagpapakita ng mga katangian ng oxidizing. Tanong: Anong mga kemikal na katangian ng mga acid ang alam mo? Ginagamit din ito bilang pang-imbak (food additive E220). Dahil ang gas na ito ay pumapatay ng mga mikroorganismo, ito ay ginagamit upang magpausok sa mga tindahan ng gulay at mga bodega. Ang mga pyrometallurgical na negosyo ng non-ferrous at ferrous metallurgy, pati na rin ang mga thermal power plant, taun-taon ay naglalabas ng sampu-sampung milyong toneladang sulfuric anhydride sa atmospera. 4. Ang mga reaksyon ng self-oxidation-self-reduction ng sulfur ay posible rin kapag nakipag-ugnayan ito sa mga sulfites. Kaya, ang SO2, sulfurous acid at mga asing-gamot nito ay maaaring magpakita ng parehong pag-oxidizing at pagbabawas ng mga katangian. Ang hydrogen sulfide ay ginagamit para sa produksyon ng sulfur, sulfites, thiosulfates at sulfuric acid, at sa laboratory practice para sa precipitation ng sulfides. Ginagamit ito sa paggawa ng phosphoric, hydrochloric, boric, hydrofluoric at iba pang mga acid. Nagpapakita ito ng mga tipikal na katangian ng acidic oxides at lubos na natutunaw sa tubig, na bumubuo ng mahinang sulfurous acid. Mga katangian ng kemikal Ang sulfuric acid ay higit na nakasalalay sa konsentrasyon nito. Ang Copper sulfate CuSO4 5H2O ay ginagamit sa agrikultura upang labanan ang mga peste at sakit ng halaman.
Mga compound ng sulfur na may estado ng oksihenasyon +13. Sumulat ng mga equation ng reaksyon na nagpapakilala sa mga katangian ng dilute sulfuric acid bilang isang electrolyte. Ang plastik na sulfur ay madilim ang kulay at maaaring mag-inat na parang goma. Ang proseso ng oksihenasyon ng isang oksido patungo sa isa pa ay nababaligtad. Thermal effect mga reaksiyong kemikal. Pana-panahong pagbabago sa mga katangian ng oxides, hydroxides, hydrogen compounds mga elemento ng kemikal. Pisikal at kemikal na katangian ng hydrogen. Natutunaw sa tubig upang bumuo ng hindi matatag na sulfurous acid; solubility 11.5 g/100 g tubig sa 20 °C, bumababa sa pagtaas ng temperatura. Ang vasodilating effect na ito ng sulfur dioxide ay pinapamagitan sa pamamagitan ng ATP-sensitive calcium channels at L-type calcium channels ("dihydropyridine"). Ang sulfur dioxide sa kapaligiran ng Earth ay makabuluhang nagpapahina sa impluwensya ng mga greenhouse gases (carbon dioxide, methane) sa pagtaas ng temperatura sa atmospera. Ang iba't ibang anyo ng sulfur trioxide ay nauugnay sa kakayahan ng mga molekula ng SO3 na mag-polymerize dahil sa pagbuo ng mga donor-acceptor bond. Ang mga polymeric na istruktura ng SO3 ay madaling nagbabago sa isa't isa, at ang solid SO3 ay karaniwang binubuo ng isang halo iba't ibang anyo, ang kamag-anak na nilalaman nito ay nakasalalay sa mga kondisyon para sa pagkuha ng sulfuric anhydride. Ang iron sulfate na FeSO4 7H2O ay dating ginamit upang gamutin ang mga scabies, helminthiasis at gland tumor, at kasalukuyang ginagamit upang kontrolin ang mga peste sa agrikultura. Ang asin ng Glauber (mirabilite) Na2SO4 10H2O ay nakuha ng German chemist na si I.R Glauber sa pamamagitan ng pagkilos ng sulfuric acid sa sodium chloride na ginagamit ito bilang isang laxative.
Ito ay hindi matatag at nabubulok sa sulfur dioxide at tubig. Ang sulfurous acid ay hindi isang malakas na acid. Ito ay isang acid ng katamtamang lakas at dissociates stepwise. Nagre-react ang sulfuric acid tatlong uri: acid-base, pagpapalitan ng ion, redox. Ang mga reaksyong ito ay pinakamahusay na isinasagawa gamit ang dilute sulfuric acid. Ang sulfuric acid ay nailalarawan sa pamamagitan ng mga reaksyon ng pagpapalitan ng ion. Ang ebolusyon ng gas ay nangyayari sa mga reaksyon sa mga asin ng hindi matatag na mga acid, na nabubulok upang bumuo ng mga gas (carbonic, sulfur dioxide, hydrogen sulfide) o upang bumuo ng mga volatile acid tulad ng hydrochloric acid. Pansin! Ang mga slide preview ay para sa mga layuning pang-impormasyon lamang at maaaring hindi kumakatawan sa lahat ng mga tampok ng pagtatanghal. Takdang-Aralin: Sumulat ng isang equation para sa paghihiwalay ng sulfurous acid.
Kapansin-pansin, ang sensitivity sa SO2 ay malawak na nag-iiba sa mga indibidwal, hayop at halaman. Ang sodium thiosulfate ay naglalaman ng dalawang sulfur atoms sa iba't ibang estado ng oksihenasyon at nagpapakita ng mga nagpapababang katangian. Bina-decolorize ng SO2 ang mga organikong tina at ginagamit sa pagpapaputi ng sutla, lana at dayami. Ang concentrated sulfuric acid ay ginagamit upang linisin ang mga produktong petrolyo mula sa sulfur at unsaturated mga organikong compound. Dahil sa mataas na hygroscopicity nito, ginagamit ito para sa pagpapatuyo ng mga gas at para sa pag-concentrate nitric acid. Hydrogen sulfide at sulfide. Kapag ang hydrogen sulfide ay natunaw sa tubig, ang mahinang hydrosulfide acid ay nabuo, na ang mga asing-gamot ay tinatawag na sulfides. Ang mga asin ng sulfurous acid, bilang isang dibasic acid, ay maaaring medium - sulfites, halimbawa sodium sulfite Na2SO3, at acidic - hydrosulfites, halimbawa sodium hydrosulfite NaHSO3. Ginagamit din ito bilang solvent sa mga laboratoryo. Guro: Ang sulfurous acid ay isang hindi matatag na tambalan, madaling nabubulok sa sulfur oxide (IV) at tubig, samakatuwid ito ay umiiral lamang sa mga may tubig na solusyon. Sa absorption tower, ang sulfur oxide (VI) ay sinisipsip ng concentrated sulfuric acid. Dahil sa edukasyon sa malalaking dami Bilang isang basura, ang sulfur dioxide ay isa sa mga pangunahing gas na nagpaparumi sa kapaligiran. Ang sulfur oxide (sulfur dioxide, sulfur dioxide, sulfur dioxide) ay isang walang kulay na gas na sa ilalim ng normal na mga kondisyon ay may matalim na katangian ng amoy (katulad ng amoy ng isang nasusunog na posporo). Natunaw sa ilalim ng presyon temperatura ng silid. Ang sulfur dioxide ay natutunaw sa tubig, at ang hindi matatag na sulfuric acid ay nabuo. Ang sangkap na ito ay natutunaw din sa sulfuric acid at ethanol. Ito ay isa sa mga pangunahing sangkap na bumubuo ng mga gas ng bulkan. Sulfur dioxide Pagkuha ng SO2 - sulfur dioxide - industriyal ay binubuo ng nasusunog na asupre o litson sulfide (pangunahing pyrite ang ginagamit). 4FeS2 (pyrite) + 11O2 = 2Fe2O3 + 8SO2 (sulfur dioxide). Sa isang setting ng laboratoryo, ang sulfur dioxide ay maaaring gawin sa pamamagitan ng paggamot sa hydrosulfites at sulfites na may malakas na acids. Sa kasong ito, ang nagreresultang sulfurous acid ay agad na bumagsak sa tubig at sulfur dioxide. Halimbawa: Na2SO3 + H2SO4 (sulfuric acid) = Na2SO4 + H2SO3 (sulfurous acid). Ang ikatlong paraan ng paggawa ng sulfur dioxide ay nagsasangkot ng pagkilos ng puro sulfuric acid sa mga mababang-aktibong metal kapag pinainit. Halimbawa: Cu (copper) + 2H2SO4 (sulfuric acid) = CuSO4 (copper sulfate) + SO2 (sulfur dioxide) + 2H2O (tubig). Mga kemikal na katangian ng sulfur dioxide Ang formula ng sulfur dioxide ay SO3. Ang sangkap na ito ay kabilang sa mga acid oxide. 1. Ang sulfur dioxide ay natutunaw sa tubig, na nagreresulta sa sulfurous acid. Sa ilalim ng normal na mga kondisyon, ang reaksyong ito ay mababaligtad. SO2 (sulfur dioxide) + H2O (tubig) = H2SO3 (sulfurous acid). 2. Sa alkalis, ang sulfur dioxide ay bumubuo ng sulfites. Halimbawa: 2NaOH (sodium hydroxide) + SO2 (sulfur dioxide) = Na2SO3 (sodium sulfite) + H2O (tubig). 3. Ang aktibidad ng kemikal ng sulfur dioxide ay medyo mataas. Ang pagbabawas ng mga katangian ng sulfur dioxide ay pinaka-binibigkas. Sa ganitong mga reaksyon, ang estado ng oksihenasyon ng asupre ay tumataas. Halimbawa: 1) SO2 (sulfur dioxide) + Br2 (bromine) + 2H2O (tubig) = H2SO4 (sulfuric acid) + 2HBr (hydrogen bromide); 2) 2SO2 (sulfur dioxide) + O2 (oxygen) = 2SO3 (sulfite); 3) 5SO2 (sulfur dioxide) + 2KMnO4 (potassium permanganate) + 2H2O (tubig) = 2H2SO4 (sulfuric acid) + 2MnSO4 (manganese sulfate) + K2SO4 (potassium sulfate). Ang huling reaksyon ay isang halimbawa ng isang husay na reaksyon sa SO2 at SO3. Ang solusyon ay nagiging kulay ube.) 4. Sa pagkakaroon ng malakas na mga ahente ng pagbabawas, ang sulfur dioxide ay maaaring magpakita ng mga katangian ng oxidizing. Halimbawa, upang kunin ang sulfur mula sa mga gas na tambutso sa industriya ng metalurhiko, ginagamit nila ang pagbabawas ng sulfur dioxide na may carbon monoxide (CO): SO2 (sulfur dioxide) + 2CO (carbon monoxide) = 2CO2 + S (sulfur). Gayundin, ang mga katangian ng oxidizing ng sangkap na ito ay ginagamit upang makakuha ng phosphorous acid: PH3 (phosphine) + SO2 (sulfur dioxide) = H3PO2 (phosphorous acid) + S (sulfur). Saan ginagamit ang sulfur dioxide? Ang sulfur dioxide ay pangunahing ginagamit upang makagawa ng sulfuric acid. Ginagamit din ito sa paggawa ng mga inuming may mababang alkohol (alak at iba pang inuming nasa kalagitnaan ng presyo). Dahil sa ari-arian ng gas na ito na pumatay ng iba't ibang microorganism, ito ay ginagamit upang mag-fumigate mga bodega at imbakan ng gulay. Bilang karagdagan, ang sulfur oxide ay ginagamit sa pagpapaputi ng lana, sutla, at dayami (mga materyales na hindi mapapaputi ng chlorine). Sa mga laboratoryo, ang sulfur dioxide ay ginagamit bilang isang solvent at upang makakuha ng iba't ibang mga asing-gamot ng sulfur dioxide. Mga epekto sa pisyolohikal Ang sulfur dioxide ay may malakas na nakakalason na katangian. Ang mga sintomas ng pagkalason ay ubo, runny nose, pamamalat, kakaibang lasa sa bibig, at matinding pananakit ng lalamunan. Kapag ang sulfur dioxide ay nalalanghap sa mataas na konsentrasyon, nahihirapang lumunok at mabulunan, magaganap ang pagkagambala sa pagsasalita, pagduduwal at pagsusuka, at maaaring magkaroon ng talamak na pulmonary edema. MPC ng sulfur dioxide: Ang pagiging sensitibo sa sulfur dioxide ay nag-iiba sa mga indibidwal, halaman, at hayop. Halimbawa, sa mga puno ang pinaka-lumalaban ay oak at birch, at ang hindi bababa sa lumalaban ay spruce at pine. Sa artikulong ito makakahanap ka ng impormasyon tungkol sa kung ano ang sulfur oxide. Ang mga pangunahing kemikal at pisikal na katangian nito, mga umiiral na anyo, mga pamamaraan ng kanilang paghahanda at mga pagkakaiba sa bawat isa ay isasaalang-alang. Ang mga aplikasyon at biyolohikal na papel ng oksido na ito sa iba't ibang anyo nito ay babanggitin din. Ano ang sangkapAng sulfur oxide ay isang tambalan ng mga simpleng sangkap, sulfur at oxygen. Mayroong tatlong anyo ng mga sulfur oxide, na naiiba sa antas ng valence S, katulad: SO (sulfur monoxide, sulfur monoxide), SO 2 (sulfur dioxide o sulfur dioxide) at SO 3 (sulfur trioxide o anhydride). Ang lahat ng nakalistang variation ng sulfur oxides ay may katulad na kemikal at pisikal na katangian. Pangkalahatang impormasyon tungkol sa sulfur monoxideAng divalent sulfur monoxide, o kung hindi man sulfur monoxide, ay isang inorganikong substance na binubuo ng dalawang simpleng elemento - sulfur at oxygen. Formula - KAYA. Sa ilalim ng normal na mga kondisyon, ito ay isang walang kulay na gas, ngunit may masangsang at tiyak na amoy. Tumutugon sa isang may tubig na solusyon. Isang pambihirang tambalan sa atmospera ng daigdig. Ito ay hindi matatag sa temperatura at umiiral sa dimeric na anyo - S 2 O 2 . Minsan ito ay may kakayahang makipag-ugnayan sa oxygen upang bumuo ng sulfur dioxide bilang isang resulta ng reaksyon. Hindi bumubuo ng mga asin.
Ang sulfur oxide (2) ay kadalasang nakukuha sa pamamagitan ng pagsunog ng sulfur o pagbubulok ng anhydride nito:
Ang sangkap ay natutunaw sa tubig. Bilang resulta, ang sulfur oxide ay bumubuo ng thiosulfuric acid:
Pangkalahatang data sa sulfur dioxideAng sulfur oxide ay isa pang anyo ng mga sulfur oxide na may pormula ng kemikal SO2. Mayroon itong hindi kanais-nais na tiyak na amoy at walang kulay. Kapag napapailalim sa presyon, maaari itong mag-apoy sa temperatura ng silid. Kapag natunaw sa tubig, ito ay bumubuo ng hindi matatag na sulfurous acid. Maaaring matunaw sa mga solusyon sa ethanol at sulfuric acid. Ito ay bahagi ng volcanic gas.
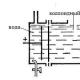
Sa industriya ito ay nakukuha sa pamamagitan ng pagsunog ng asupre o pag-ihaw ng mga sulfide nito:
Sa mga laboratoryo, bilang panuntunan, ang SO 2 ay nakuha gamit ang mga sulfites at hydrosulfites, na inilalantad ang mga ito sa malakas na acid, pati na rin ang pagkakalantad ng mga metal na may mababang antas ng aktibidad sa puro H 2 SO 4. Tulad ng ibang mga sulfur oxide, ang SO2 ay isang acidic oxide. Nakikipag-ugnayan sa alkalis, na bumubuo ng iba't ibang mga sulfites, tumutugon ito sa tubig, na lumilikha ng sulfuric acid. Ang SO 2 ay lubos na aktibo, at ito ay malinaw na ipinahayag sa pagbabawas ng mga katangian nito, kung saan ang estado ng oksihenasyon ng sulfur oxide ay tumataas. Maaaring magpakita ng mga katangian ng oxidizing kung nalantad sa isang malakas na ahente ng pagbabawas. Ang huli katangiang katangian ginagamit para sa paggawa ng hypophosphorous acid, o para sa paghihiwalay ng S mula sa mga gas sa larangan ng metalurhiko. Ang sulfur oxide (4) ay malawakang ginagamit ng mga tao upang makagawa ng sulfurous acid o mga asin nito - ito ang pangunahing lugar ng aplikasyon nito. Nakikilahok din ito sa mga proseso ng paggawa ng alak at kumikilos doon bilang isang pang-imbak (E220); Ang mga materyales na hindi mapapaputi ng chlorine ay ginagamot ng sulfur oxide.
Ang SO 2 ay isang medyo nakakalason na tambalan. Ang mga katangiang sintomas na nagpapahiwatig ng pagkalason ay ang pag-ubo, mga problema sa paghinga, kadalasan sa anyo ng isang runny nose, pamamaos, isang hindi pangkaraniwang lasa at isang namamagang lalamunan. Ang paglanghap ng gas na ito ay maaaring magdulot ng pagka-suffocation, kapansanan sa pagsasalita, pagsusuka, kahirapan sa paglunok, at pulmonary edema sa indibidwal. talamak na anyo. Ang maximum na pinapayagang konsentrasyon ng sangkap na ito sa lugar ng trabaho ay 10 mg/m3. Gayunpaman, ang iba't ibang mga katawan ng tao ay maaaring magpakita ng iba't ibang sensitivity sa sulfur dioxide. Pangkalahatang impormasyon tungkol sa sulfuric anhydrideAng sulfur gas, o sulfuric anhydride kung tawagin, ay isang mas mataas na oxide ng sulfur na may kemikal na formula SO 3 . Liquid na may nakaka-suffocating na amoy, lubhang pabagu-bago kapag karaniwang kondisyon. Ito ay may kakayahang patigasin, pagbuo ng mga mala-kristal na halo mula sa mga solidong pagbabago nito, sa temperaturang 16.9 °C at mas mababa.
Detalyadong pagsusuri ng mas mataas na oksidoKapag ang SO 2 ay na-oxidize ng hangin sa ilalim ng impluwensya ng mataas na temperatura, isang kinakailangang kondisyon ay ang pagkakaroon ng isang katalista, halimbawa V 2 O 5, Fe 2 O 3, NaVO 3 o Pt. Thermal decomposition ng sulfates o interaksyon ng ozone at SO 2:
Oxidation ng SO 2 na may NO 2:
Ang mga katangian ng pisikal na husay ay kinabibilangan ng: ang presensya sa estado ng gas ng isang patag na istraktura, uri ng trigonal at D 3 h symmetry sa panahon ng paglipat mula sa gas sa kristal o likido, ito ay bumubuo ng isang trimer ng isang cyclic na kalikasan at isang zigzag chain, at may isang; covalent polar bond. Sa solidong anyo, ang SO 3 ay nangyayari sa mga anyo ng alpha, beta, gamma at sigma, at ito ay, nang naaayon, iba't ibang mga punto ng pagkatunaw, antas ng polimerisasyon at iba't ibang mga kristal na anyo. Ang pagkakaroon ng naturang bilang ng mga uri ng SO 3 ay dahil sa pagbuo ng mga donor-acceptor type bond. Ang mga katangian ng sulfur anhydride ay kinabibilangan ng marami sa mga katangian nito, ang mga pangunahing ay: Kakayahang makipag-ugnayan sa mga base at oxide:
Ang mas mataas na sulfur oxide SO3 ay may mataas na aktibidad at lumilikha ng sulfuric acid sa pamamagitan ng pakikipag-ugnayan sa tubig:
Tumutugon ito sa hydrogen chloride at bumubuo ng chlorosulfate acid:
Ang sulfur oxide ay nailalarawan sa pamamagitan ng pagpapakita ng malakas na mga katangian ng oxidizing. Ang sulfuric anhydride ay ginagamit sa paglikha ng sulfuric acid. Ang isang maliit na halaga nito ay inilabas sa kapaligiran habang gumagamit ng sulfur bomb. Ang SO 3, na bumubuo ng sulfuric acid pagkatapos ng pakikipag-ugnayan sa isang basang ibabaw, ay sumisira sa iba't ibang mapanganib na organismo, tulad ng fungi. Summing upAng sulfur oxide ay matatagpuan sa iba't ibang estado ng pagsasama-sama mula sa likido hanggang sa solidong anyo. Ito ay bihira sa kalikasan, ngunit may ilang mga paraan upang makuha ito sa industriya, pati na rin sa mga lugar kung saan ito magagamit. Ang oxide mismo ay may tatlong anyo kung saan ito ay nagpapakita ng iba't ibang antas ng valency. Maaaring lubhang nakakalason at magdulot ng malubhang problema sa kalusugan. Ang +4 na estado ng oksihenasyon para sa asupre ay medyo matatag at nagpapakita ng sarili sa SHal 4 tetrahalides, SOHal 2 oxodihalides, SO 2 dioxide at ang kanilang mga kaukulang anion. Makikilala natin ang mga katangian ng sulfur dioxide at sulfurous acid. 1.11.1. Sulfur (IV) oxide Istraktura ng so2 moleculeAng istraktura ng molekula ng SO 2 ay katulad ng istraktura ng molekula ng ozone. Ang sulfur atom ay nasa estado ng sp 2 hybridization, ang hugis ng mga orbital ay isang regular na tatsulok, at ang hugis ng molekula ay angular. Ang sulfur atom ay may nag-iisang pares ng mga electron. Ang haba ng bono ng S–O ay 0.143 nm, at ang anggulo ng bono ay 119.5°. Ang istraktura ay tumutugma sa mga sumusunod na resonant na istruktura: Hindi tulad ng ozone, ang multiplicity ng S-O bond ay 2, iyon ay, ang pangunahing kontribusyon ay ginawa ng unang resonance structure. Ang molekula ay nailalarawan sa pamamagitan ng mataas na thermal stability. Mga katangiang pisikalSa ilalim ng normal na mga kondisyon, ang sulfur dioxide o sulfur dioxide ay isang walang kulay na gas na may matalim na nakakasakal na amoy, natutunaw na punto -75 °C, kumukulo -10 °C. Ito ay lubos na natutunaw sa tubig sa 20 °C, 40 volume ng sulfur dioxide ay natutunaw sa 1 volume ng tubig. Nakakalasong gas. Mga kemikal na katangian ng sulfur (IV) oxideAng sulfur dioxide ay lubos na reaktibo. Ang sulfur dioxide ay isang acidic oxide. Ito ay lubos na natutunaw sa tubig upang bumuo ng mga hydrates. Bahagyang tumutugon din ito sa tubig, na bumubuo ng mahinang sulfurous acid, na hindi nakahiwalay sa indibidwal na anyo: SO 2 + H 2 O = H 2 SO 3 = H + + HSO 3 - = 2H + + SO 3 2- . Bilang resulta ng dissociation, ang mga proton ay nabuo, kaya ang solusyon ay may acidic na kapaligiran. Kapag ang sulfur dioxide gas ay dumaan sa isang solusyon ng sodium hydroxide, ang sodium sulfite ay nabuo. Ang sodium sulfite ay tumutugon sa labis na sulfur dioxide upang bumuo ng sodium hydrosulfite: 2NaOH + SO 2 = Na 2 SO 3 + H 2 O; Ang sulfur dioxide ay nailalarawan sa pamamagitan ng redox duality; SO 2 + Br 2 + 2H 2 O = H 2 SO 4 + 2HBr at potassium permanganate solution: 5SO 2 + 2KMnO 4 + 2H 2 O = 2KНSO 4 + 2MnSO 4 + H 2 SO 4. na-oxidized ng oxygen sa sulfuric anhydride: 2SO 2 + O 2 = 2SO 3. Nagpapakita ito ng mga katangian ng oxidizing kapag nakikipag-ugnayan sa malakas na mga ahente ng pagbabawas, halimbawa: SO 2 + 2CO = S + 2CO 2 (sa 500 °C, sa presensya ng Al 2 O 3); SO 2 + 2H 2 = S + 2H 2 O. Paghahanda ng sulfur oxide (IV)Pagkasunog ng asupre sa hangin S + O 2 = SO 2. Oksihenasyon ng sulfide 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2. Epekto ng malakas na acids sa metal sulfites Na 2 SO 3 + 2H 2 SO 4 = 2NaHSO 4 + H 2 O + SO 2. 1.11.2. Sulfurous acid at mga asin nitoKapag ang sulfur dioxide ay natunaw sa tubig, ang mahinang sulfurous acid ay nabuo, ang bulk ng dissolved SO 2 ay nasa anyo ng hydrated form na SO 2 ·H 2 O sa paglamig, ang crystalline hydrate ay inilabas din, isang maliit na bahagi lamang ng ang mga molekula ng sulfurous acid ay naghihiwalay sa sulfite at hydrosulfite ions. Sa libreng estado, ang acid ay hindi inilabas. Ang pagiging dibasic, bumubuo ito ng dalawang uri ng mga asing-gamot: medium - sulfites at acidic - hydrosulfites. Tanging sulfites ng alkali metal at hydrosulfites ng alkali at alkaline earth metal ang natutunaw sa tubig. Hydrogen sulfide - H2S Mga compound ng asupre -2, +4, +6. Mga husay na reaksyon sa sulfide, sulfites, sulfates. Resibo sa pakikipag-ugnayan: 1. hydrogen na may sulfur sa t – 300 0 2. kapag kumikilos sa sulfide ng mga mineral acid: Na 2 S+2HCl =2 NaCl+H 2 S isang walang kulay na gas, na may amoy ng bulok na mga itlog, nakakalason, mas mabigat kaysa sa hangin, na natutunaw sa tubig, ito ay bumubuo ng mahinang hydrogen sulfide acid. Mga katangian ng kemikal Mga katangian ng acid-base 1. Ang solusyon ng hydrogen sulfide sa tubig - hydrosulfide acid - ay isang mahinang dibasic acid, samakatuwid ito ay naghihiwalay nang sunud-sunod: H 2 S ↔ HS - + H + HS - ↔ H - + S 2- 2. Ang hydrogen sulfide acid ay may pangkalahatang katangian acid, tumutugon sa mga metal, pangunahing oksido, base, asin: H 2 S + Ca = CaS + H 2 H 2 S + CaO = CaS + H 2 O H 2 S + 2NaOH = Na 2 S + 2H 2 O H 2 S + CuSO 4 = CuS↓ + H 2 SO 4 Lahat ng acid salts - hydrosulfides - ay lubos na natutunaw sa tubig. Ang mga normal na asing-gamot - sulfide - natutunaw sa tubig sa iba't ibang paraan: ang mga sulfide ng alkali at alkaline earth na mga metal ay lubos na natutunaw, ang mga sulfide ng iba pang mga metal ay hindi natutunaw sa tubig, at ang mga sulfide ng tanso, tingga, mercury at ilang iba pang mabibigat na metal ay hindi natutunaw kahit na sa mga acid (maliban sa nitric acid) CuS+4HNO 3 =Cu(NO 3) 2 +3S+2NO+2H 2 O Ang mga natutunaw na sulfide ay sumasailalim sa hydrolysis - sa anion. Na 2 S ↔ 2Na + + S 2- S 2- +HOH ↔HS - +OH - Na 2 S + H 2 O ↔ NaHS + NaOH Ang isang qualitative na reaksyon sa hydrosulfide acid at ang mga natutunaw na asin nito (i.e., sa sulfide ion S 2-) ay ang kanilang pakikipag-ugnayan sa mga natutunaw na lead salt, na nagreresulta sa pagbuo ng isang itim na PbS precipitate Na 2 S + Pb(NO 3) 2 = 2NaNO 3 + PbS↓ Pb 2+ + S 2- = PbS↓
Nagpapakita lamang ng mga restorative properties, dahil ang sulfur atom ay may pinakamababang estado ng oksihenasyon -2 1. may oxygen a) na may kawalan 2H 2 S -2 +O 2 0 = S 0 +2H 2 O -2 b) na may labis na oxygen 2H 2 S+3O 2 =2SO 2 +2H 2 O 2. may mga halogens (bromine water discoloration) H 2 S -2 +Br 2 =S 0 +2HBr -1 3. may conc. HNO3 H 2 S+2HNO 3 (k) = S+2NO 2 +2H 2 O b) na may malakas na oxidizing agent (KMnO 4, K 2 CrO 4 sa isang acidic na kapaligiran) 2KMnO 4 +3H 2 SO 4 +5H 2 S = 5S+2MnSO 4 +K 2 SO 4 +8H 2 O c) ang hydrosulfide acid ay na-oxidized hindi lamang ng mga malakas na ahente ng oxidizing, kundi pati na rin ng mga mas mahina, halimbawa, iron (III) salts, sulfurous acid, atbp. 2FeCl 3 + H 2 S = 2FeCl 2 + S + 2HCl H 2 SO 3 + 2H 2 S = 3S + 3H 2 O Resibo 1. pagkasunog ng asupre sa oxygen. 2. pagkasunog ng hydrogen sulfide sa labis na O 2 2H 2 S+3O 2 = 2SO 2 +2H 2 O 3. sulfide oksihenasyon 2CuS+3O2 = 2SO2 +2CuO 4. pakikipag-ugnayan ng sulfites sa mga acid Na 2 SO 3 +H 2 SO 4 =Na 2 SO 4 +SO 2 +H 2 O 5. interaksyon ng mga metal sa serye ng aktibidad pagkatapos ng (H 2) na may conc. H2SO4 Cu+2H 2 SO 4 = CuSO 4 + SO 2 +2H 2 O Mga katangiang pisikal Gas, walang kulay, na may nakasusuklam na amoy ng sinunog na asupre, nakakalason, higit sa 2 beses na mas mabigat kaysa sa hangin, lubos na natutunaw sa tubig (sa temperatura ng silid, humigit-kumulang 40 volume ng gas ang natutunaw sa isang volume). Mga katangian ng kemikal: Mga katangian ng acid-base Ang SO 2 ay isang tipikal na acidic oxide. 1.may alkalis, na bumubuo ng dalawang uri ng mga asing-gamot: sulfites at hydrosulfites 2KOH+SO2 = K2SO3 +H2O KOH+SO 2 = KHSO 3 +H 2 O 2.may mga pangunahing oksido K 2 O+SO 2 = K 2 SO 3 3. ang mahinang sulfurous acid ay nabuo sa tubig H 2 O+SO 2 = H 2 SO 3 Ang sulfurous acid ay umiiral lamang sa solusyon at ito ay isang mahinang acid. ay may lahat ng pangkalahatang katangian ng mga acid. 4. qualitative reaction sa sulfite - ion - SO 3 2 - aksyon ng mga mineral acid Na 2 SO 3 +2HCl= 2Na 2 Cl+SO 2 +H 2 O amoy ng nasusunog na asupre Mga katangian ng redox Sa ORR maaari itong maging parehong ahente ng oxidizing at ahente ng pagbabawas, dahil ang sulfur atom sa SO 2 ay may intermediate na estado ng oksihenasyon na +4. Bilang isang ahente ng oxidizing: SO 2 + 2H 2 S = 3S + 2H 2 S Bilang isang ahente ng pagbabawas: 2SO 2 +O 2 = 2SO 3 Cl 2 +SO 2 +2H 2 O = H 2 SO 4 +2HCl 2KMnO 4 +5SO 2 +2H 2 O = K 2 SO 4 +2H 2 SO 4 +2MnSO 4 Sulfur oxide (VI) SO 3 (sulfuric anhydride) Resibo: Oksihenasyon ng sulfur dioxide 2SO 2 + O 2 = 2SO 3 ( t 0 , kat) Mga katangiang pisikal Ang isang walang kulay na likido, sa temperatura sa ibaba 17 0 C ito ay nagiging isang puting mala-kristal na masa. Therly unstable compound, ganap na nabubulok sa 700 0 C. Ito ay lubos na natutunaw sa tubig at anhydrous sulfuric acid at tumutugon dito upang bumuo ng oleum SO 3 + H 2 SO 4 = H 2 S 2 O 7 Mga katangian ng kemikal Mga katangian ng acid-base Karaniwang acid oxide. 1.may alkalis, na bumubuo ng dalawang uri ng mga asing-gamot: sulfates at hydrosulfates 2KOH+SO 3 = K 2 SO 4 +H 2 O KOH+SO 3 = KHSO 4 +H 2 O 2.may mga pangunahing oksido CaO+SO 2 = CaSO 4 3. may tubig H 2 O + SO 3 = H 2 SO 4 Mga katangian ng redox Ang sulfur oxide (VI) ay isang malakas na ahente ng oxidizing, kadalasang nababawasan sa SO 2 3SO 3 + H 2 S = 4SO 2 + H 2 O Sulfuric acid H 2 SO 4 Paghahanda ng sulfuric acid Sa industriya, ang acid ay ginawa sa pamamagitan ng paraan ng pakikipag-ugnay: 1. pagpapaputok ng pyrite 4FeS 2 +11O 2 = 2Fe 2 O 3 + 8SO 2 2. oksihenasyon ng SO 2 hanggang SO 3 2SO 2 + O 2 = 2SO 3 ( t 0 , kat) 3. paglusaw ng SO 3 sa sulfuric acid n SO 3 + H 2 SO 4 = H 2 SO 4 ∙ n SO 3 (oleum) H2SO4∙ n SO 3 + H 2 O = H 2 SO 4 Mga katangiang pisikal Ang H 2 SO 4 ay isang mabigat na madulas na likido, walang amoy at walang kulay, hygroscopic. Hinahalo sa tubig sa anumang ratio; kapag ang puro sulfuric acid ay natunaw sa tubig, ang isang malaking halaga ng init ay inilabas, kaya dapat itong maingat na ibuhos sa tubig, at hindi kabaligtaran (unang tubig, pagkatapos ay acid, kung hindi man malaking problema ang mangyayari) Ang isang solusyon ng sulfuric acid sa tubig na may H 2 SO 4 na nilalaman na mas mababa sa 70% ay karaniwang tinatawag na dilute sulfuric acid, higit sa 70% - puro. Mga katangian ng kemikal Acid-base Ang dilute sulfuric acid ay nagpapakita ng lahat ng katangian ng mga malakas na acid. Naghihiwalay sa may tubig na solusyon: H 2 SO 4 ↔ 2H + + SO 4 2- 1. na may mga pangunahing oksido MgO + H 2 SO 4 = MgSO 4 + H 2 O 2. may mga batayan 2NaOH +H 2 SO 4 = Na 2 SO 4 + 2H 2 O 3. may mga asin BaCl 2 + H 2 SO 4 = BaSO 4 ↓ + 2HCl Ba 2+ + SO 4 2- = BaSO 4 ↓ (white precipitate) Kwalitatibong reaksyon sa sulfate ion SO 4 2- Salamat sa higit pa mataas na temperatura kumukulo, kumpara sa iba pang mga acid, ang sulfuric acid, kapag pinainit, ay inilipat ang mga ito mula sa mga asing-gamot: NaCl + H 2 SO 4 = HCl + NaHSO 4 Mga katangian ng redox Sa dilute H 2 SO 4 ang oxidizing agents ay H + ions, at sa concentrated H 2 SO 4 ang oxidizing agents ay SO 4 2 sulfate ions. Ang mga metal sa serye ng aktibidad hanggang sa hydrogen ay natutunaw sa dilute na sulfuric acid, ang mga sulfate ay nabuo at ang hydrogen ay inilabas. Zn + H 2 SO 4 = ZnSO 4 + H 2 Ang concentrated sulfuric acid ay isang masiglang oxidizing agent, lalo na kapag pinainit. Ito ay nag-oxidize ng maraming mga metal, non-metal, inorganic at organic na mga sangkap. H 2 SO 4 (k) oxidizing agent S +6 Sa mas aktibong mga metal, ang sulfuric acid ay maaaring mabawasan sa iba't ibang mga produkto depende sa konsentrasyon Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O 3Zn + 4H 2 SO 4 = 3ZnSO 4 + S + 4H 2 O 4Zn + 5H 2 SO 4 = 4ZnSO 4 + H 2 S + 4H 2 O Ang concentrated sulfuric acid ay nag-oxidize ng ilang mga non-metal (sulfur, carbon, phosphorus, atbp.), na binabawasan sa sulfur oxide (IV) S + 2H 2 SO 4 = 3SO 2 + 2H 2 O C + 2H 2 SO 4 = 2SO 2 + CO 2 + 2H 2 O Pakikipag-ugnayan sa ilang mga kumplikadong sangkap H 2 SO 4 + 8HI = 4I 2 + H 2 S + 4 H 2 O H 2 SO 4 + 2HBr = Br 2 + SO 2 + 2H 2 O Mga asin ng sulfuric acid 2 uri ng mga asing-gamot: sulfates at hydrosulfates Ang mga asin ng sulfuric acid ay may lahat ng pangkalahatang katangian ng mga asin. Espesyal ang kanilang relasyon sa init. Ang mga sulpate ng mga aktibong metal (Na, K, Ba) ay hindi nabubulok kahit na pinainit sa itaas ng 1000 0 C, ang mga asin ng hindi gaanong aktibong mga metal (Al, Fe, Cu) ay nabubulok kahit na may bahagyang pag-init |
Sikat:
Bago
- Posible bang tanggalin ang isang balo na may anak?
- Paggamot ng pinsala sa rectal mucosa Halos dumanas ng pagkalagot ng tumbong
- Nahaharap ba ang planeta sa World War III?
- Kasaysayan ng Sodoma at Gomorra
- Ang Banal na Espiritu - bakit kailangan natin ito Sino ang banal na espiritu sa Christian Science
- Mga artificial sky illumination zone
- Baikonur Cosmodrome - ang unang cosmodrome sa mundo
- Mga elementong transuraniko Bakit masama ang mga transition metal
- Space elevator at nanotechnology Orbital elevator
- Mission Possible: Ang Russia ay itinalaga ng isang mahalagang papel sa ekspedisyon sa Mars