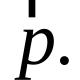|
വെള്ളത്തിൽ ലയിക്കുമ്പോൾ, എല്ലാ പദാർത്ഥങ്ങൾക്കും നടത്താനുള്ള കഴിവില്ല വൈദ്യുത പ്രവാഹം. ആ സംയുക്തങ്ങൾ, വെള്ളം പരിഹാരങ്ങൾവൈദ്യുത പ്രവാഹം നടത്താൻ കഴിവുള്ളവയെ വിളിക്കുന്നു ഇലക്ട്രോലൈറ്റുകൾ. അയോണിക് ചാലകത എന്ന് വിളിക്കപ്പെടുന്നതിനാൽ ഇലക്ട്രോലൈറ്റുകൾ വൈദ്യുതധാര നടത്തുന്നു, അയോണിക് ഘടനയുള്ള (ലവണങ്ങൾ, ആസിഡുകൾ, ബേസുകൾ) പല സംയുക്തങ്ങളും ഉൾക്കൊള്ളുന്നു. ഉയർന്ന പോളാർ ബോണ്ടുകളുള്ള പദാർത്ഥങ്ങളുണ്ട്, പക്ഷേ ലായനിയിൽ അവ അപൂർണ്ണമായ അയോണൈസേഷന് വിധേയമാകുന്നു (ഉദാഹരണത്തിന്, മെർക്കുറി ക്ലോറൈഡ് II) - ഇവ ദുർബലമായ ഇലക്ട്രോലൈറ്റുകളാണ്. പലതും ജൈവ സംയുക്തങ്ങൾ(കാർബോഹൈഡ്രേറ്റ്, ആൽക്കഹോൾ) വെള്ളത്തിൽ ലയിക്കുന്നവ അയോണുകളായി വിഘടിക്കുന്നില്ല, പക്ഷേ അവയുടെ തന്മാത്രാ ഘടന നിലനിർത്തുന്നു. അത്തരം പദാർത്ഥങ്ങൾ വൈദ്യുത പ്രവാഹം നടത്തുന്നില്ല, അവയെ വിളിക്കുന്നു നോൺ-ഇലക്ട്രോലൈറ്റുകൾ. ഒരു പ്രത്യേക സംയുക്തം ശക്തമോ ദുർബലമോ ആയ ഇലക്ട്രോലൈറ്റാണോ എന്ന് നിർണ്ണയിക്കാൻ ഉപയോഗിക്കാവുന്ന ചില തത്വങ്ങൾ ഇതാ: - ആസിഡുകൾ
. ഏറ്റവും സാധാരണമായ ശക്തമായ ആസിഡുകളിൽ HCl, HBr, HI, HNO 3, H 2 SO 4, HClO 4 എന്നിവ ഉൾപ്പെടുന്നു. മറ്റെല്ലാ ആസിഡുകളും ദുർബലമായ ഇലക്ട്രോലൈറ്റുകളാണ്.
- കാരണങ്ങൾ.
ഏറ്റവും സാധാരണമായ ശക്തമായ അടിത്തറകൾ ആൽക്കലി, ആൽക്കലൈൻ എർത്ത് ലോഹങ്ങളുടെ ഹൈഡ്രോക്സൈഡുകളാണ് (Be ഒഴികെ). ദുർബലമായ ഇലക്ട്രോലൈറ്റ് - NH 3.
- ഉപ്പ്.
ഏറ്റവും സാധാരണമായ ലവണങ്ങൾ, അയോണിക് സംയുക്തങ്ങൾ, ശക്തമായ ഇലക്ട്രോലൈറ്റുകളാണ്. പ്രധാനമായും കനത്ത ലോഹങ്ങളുടെ ലവണങ്ങളാണ് ഒഴിവാക്കലുകൾ.
ഇലക്ട്രോലൈറ്റിക് ഡിസോസിയേഷൻ സിദ്ധാന്തംഇലക്ട്രോലൈറ്റുകൾ, ശക്തവും ദുർബലവും വളരെ നേർപ്പിച്ചതും പോലും അനുസരിക്കില്ല റൗൾട്ടിൻ്റെ നിയമംഒപ്പം . വൈദ്യുതമായി നടത്താനുള്ള കഴിവ് ഉള്ളതിനാൽ, ലായകത്തിൻ്റെ നീരാവി മർദ്ദവും ഇലക്ട്രോലൈറ്റ് ലായനികളുടെ ദ്രവണാങ്കവും കുറവായിരിക്കും, കൂടാതെ ശുദ്ധമായ ലായകത്തിൻ്റെ സമാന മൂല്യങ്ങളുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ തിളയ്ക്കുന്ന പോയിൻ്റ് കൂടുതലായിരിക്കും. 1887-ൽ, ഈ വ്യതിയാനങ്ങൾ പഠിക്കുന്ന എസ്. അറേനിയസ്, ഇലക്ട്രോലൈറ്റിക് ഡിസോസിയേഷൻ സിദ്ധാന്തത്തിൻ്റെ സൃഷ്ടിയിലേക്ക് എത്തി. ഇലക്ട്രോലൈറ്റിക് ഡിസോസിയേഷൻലായനിയിലെ ഇലക്ട്രോലൈറ്റ് തന്മാത്രകൾ പോസിറ്റീവും നെഗറ്റീവ് ചാർജുള്ളതുമായ അയോണുകളായി വിഘടിക്കുന്നു, അവയെ യഥാക്രമം കാറ്റേഷനുകളും അയോണുകളും എന്ന് വിളിക്കുന്നു. സിദ്ധാന്തം ഇനിപ്പറയുന്ന പോസ്റ്റുലേറ്റുകൾ മുന്നോട്ട് വയ്ക്കുന്നു: - ലായനികളിൽ, ഇലക്ട്രോലൈറ്റുകൾ അയോണുകളായി വിഘടിക്കുന്നു, അതായത്. വേർപെടുത്തുക. ഇലക്ട്രോലൈറ്റ് ലായനി എത്രത്തോളം നേർപ്പിക്കുന്നുവോ അത്രയധികം അതിൻ്റെ വിഘടനത്തിൻ്റെ അളവ് വർദ്ധിക്കുന്നു.
- ഡിസോസിയേഷൻ റിവേഴ്സിബിൾ ആൻഡ് സന്തുലിത പ്രതിഭാസമാണ്.
- ലായക തന്മാത്രകൾ അനന്തമായി ദുർബലമായി ഇടപഴകുന്നു (അതായത്, പരിഹാരങ്ങൾ ആദർശത്തോട് അടുത്താണ്).
വ്യത്യസ്ത ഇലക്ട്രോലൈറ്റുകൾക്ക് വ്യത്യസ്ത അളവിലുള്ള ഡിസോസിയേഷൻ ഉണ്ട്, ഇത് ഇലക്ട്രോലൈറ്റിൻ്റെ സ്വഭാവത്തെ മാത്രമല്ല, ലായകത്തിൻ്റെ സ്വഭാവത്തെയും ഇലക്ട്രോലൈറ്റിൻ്റെയും താപനിലയുടെയും സാന്ദ്രതയെയും ആശ്രയിച്ചിരിക്കുന്നു. ഡിസോസിയേഷൻ ബിരുദം α
, എത്ര തന്മാത്രകൾ കാണിക്കുന്നു എൻതാരതമ്യപ്പെടുത്തുമ്പോൾ, അയോണുകളായി വിഘടിച്ചു ആകെ എണ്ണംഅലിഞ്ഞുചേർന്ന തന്മാത്രകൾ എൻ: α =
n/എൻ
വിഘടനത്തിൻ്റെ അഭാവത്തിൽ α = 0, ഇലക്ട്രോലൈറ്റിൻ്റെ പൂർണ്ണമായ വിഘടനം α = 1. വിഘടനത്തിൻ്റെ അളവിൻ്റെ വീക്ഷണകോണിൽ നിന്ന്, ശക്തി അനുസരിച്ച്, ഇലക്ട്രോലൈറ്റുകളെ ശക്തമായ (α > 0.7), ഇടത്തരം ശക്തി (0.3 > α > 0.7), ദുർബലമായ (α) എന്നിങ്ങനെ തിരിച്ചിരിക്കുന്നു.< 0,3). കൂടുതൽ കൃത്യമായി പറഞ്ഞാൽ, ഇലക്ട്രോലൈറ്റ് ഡിസോസിയേഷൻ പ്രക്രിയയുടെ സവിശേഷതയാണ് ഡിസോസിയേഷൻ സ്ഥിരാങ്കം, പരിഹാരത്തിൻ്റെ സാന്ദ്രതയിൽ നിന്ന് സ്വതന്ത്രമായി. ഇലക്ട്രോലൈറ്റ് ഡിസോസിയേഷൻ പ്രക്രിയ പൊതുവായ രൂപത്തിൽ നമ്മൾ സങ്കൽപ്പിക്കുകയാണെങ്കിൽ: A a B b ↔ aA — + bB + കെ = എ ബി / വേണ്ടി ദുർബലമായ ഇലക്ട്രോലൈറ്റുകൾഓരോ അയോണിൻ്റെയും സാന്ദ്രത ഇലക്ട്രോലൈറ്റ് C യുടെ മൊത്തം സാന്ദ്രതയാൽ α യുടെ ഉൽപ്പന്നത്തിന് തുല്യമാണ്, അതിനാൽ വിഘടന സ്ഥിരാങ്കത്തിൻ്റെ പദപ്രയോഗം രൂപാന്തരപ്പെടാം: K = α 2 C/(1-α) വേണ്ടി നേർപ്പിച്ച പരിഹാരങ്ങൾ(1-α) =1, അപ്പോൾ കെ = α2C ഇവിടെ നിന്ന് കണ്ടെത്തുന്നത് ബുദ്ധിമുട്ടുള്ള കാര്യമല്ല ഡിസോസിയേഷൻ ബിരുദം അയോണിക്-തന്മാത്രാ സമവാക്യങ്ങൾശക്തമായ അടിത്തറയുള്ള ശക്തമായ ആസിഡിൻ്റെ ന്യൂട്രലൈസേഷൻ്റെ ഒരു ഉദാഹരണം പരിഗണിക്കുക, ഉദാഹരണത്തിന്: HCl + NaOH = NaCl + HOH പ്രക്രിയ ഇതായി അവതരിപ്പിച്ചിരിക്കുന്നു തന്മാത്രാ സമവാക്യം. പ്രാരംഭ പദാർത്ഥങ്ങളും ലായനിയിലെ പ്രതിപ്രവർത്തന ഉൽപ്പന്നങ്ങളും പൂർണ്ണമായും അയോണൈസ്ഡ് ആണെന്ന് അറിയാം. അതിനാൽ, നമുക്ക് ഫോമിൽ പ്രക്രിയയെ പ്രതിനിധീകരിക്കാം സമ്പൂർണ്ണ അയോണിക് സമവാക്യം: H + + Cl - + Na + + OH - = Na + + Cl - + HOH സമവാക്യത്തിൻ്റെ ഇടത് വലത് വശങ്ങളിൽ സമാനമായ അയോണുകൾ "കുറച്ചതിന്" ശേഷം, നമുക്ക് ലഭിക്കും ചുരുക്കിയ അയോണിക് സമവാക്യം: H + + OH - = HOH ന്യൂട്രലൈസേഷൻ പ്രക്രിയ H +, OH എന്നിവയുടെ സംയോജനത്തിലേക്കും ജലത്തിൻ്റെ രൂപീകരണത്തിലേക്കും വരുന്നതായി ഞങ്ങൾ കാണുന്നു. അയോണിക് സമവാക്യങ്ങൾ രചിക്കുമ്പോൾ, ശക്തമായ ഇലക്ട്രോലൈറ്റുകൾ മാത്രമേ അയോണിക് രൂപത്തിൽ എഴുതിയിട്ടുള്ളൂ എന്ന് ഓർമ്മിക്കേണ്ടതാണ്. ദുർബലമായ ഇലക്ട്രോലൈറ്റുകൾ ഖരപദാർഥങ്ങൾവാതകങ്ങൾ അവയുടെ തന്മാത്രാ രൂപത്തിലാണ് എഴുതിയിരിക്കുന്നത്. ഡിപ്പോസിഷൻ പ്രക്രിയ, Ag +, I എന്നിവയുടെ മാത്രം പ്രതിപ്രവർത്തനത്തിലേക്കും വെള്ളത്തിൽ ലയിക്കാത്ത AgI യുടെ രൂപീകരണത്തിലേക്കും ചുരുങ്ങുന്നു. നമുക്ക് താൽപ്പര്യമുള്ള പദാർത്ഥത്തിന് വെള്ളത്തിൽ ലയിക്കാൻ കഴിയുമോ എന്ന് കണ്ടെത്താൻ, നമ്മൾ ലയിക്കാത്ത പട്ടിക ഉപയോഗിക്കേണ്ടതുണ്ട്. ഒരു അസ്ഥിര സംയുക്തത്തിൻ്റെ രൂപീകരണത്തിന് കാരണമാകുന്ന മൂന്നാമത്തെ തരം പ്രതികരണം നമുക്ക് പരിഗണിക്കാം. കാർബണേറ്റുകൾ, സൾഫൈറ്റുകൾ അല്ലെങ്കിൽ ആസിഡുകൾക്കൊപ്പം സൾഫൈഡുകൾ എന്നിവ ഉൾപ്പെടുന്ന പ്രതിപ്രവർത്തനങ്ങളാണിവ. ഉദാഹരണത്തിന്, അയോണിക് സംയുക്തങ്ങളുടെ ചില പരിഹാരങ്ങൾ മിക്സ് ചെയ്യുമ്പോൾ, അവ തമ്മിലുള്ള പ്രതിപ്രവർത്തനങ്ങൾ ഉണ്ടാകണമെന്നില്ല, ഉദാഹരണത്തിന് അതിനാൽ, ചുരുക്കത്തിൽ, ഞങ്ങൾ അത് ശ്രദ്ധിക്കുന്നു രാസ പരിവർത്തനങ്ങൾഇനിപ്പറയുന്ന വ്യവസ്ഥകളിൽ ഒന്ന് പാലിക്കുമ്പോൾ നിരീക്ഷിക്കപ്പെടുന്നു: - നോൺ-ഇലക്ട്രോലൈറ്റ് രൂപീകരണം. ജലത്തിന് ഇലക്ട്രോലൈറ്റ് അല്ലാത്തവയായി പ്രവർത്തിക്കാൻ കഴിയും.
- അവശിഷ്ടത്തിൻ്റെ രൂപീകരണം.
- ഗ്യാസ് റിലീസ്.
- ദുർബലമായ ഇലക്ട്രോലൈറ്റിൻ്റെ രൂപീകരണംഉദാഹരണത്തിന് അസറ്റിക് ആസിഡ്.
- ഒന്നോ അതിലധികമോ ഇലക്ട്രോണുകളുടെ കൈമാറ്റം.റെഡോക്സ് പ്രതികരണങ്ങളിൽ ഇത് തിരിച്ചറിയപ്പെടുന്നു.
- ഒന്നോ അതിലധികമോ രൂപീകരണം അല്ലെങ്കിൽ വിള്ളൽ.
വിഭാഗങ്ങൾ, വിഷയം: കെമിക്കൽ ബോണ്ട്. ഇലക്ട്രോലൈറ്റിക് ഡിസോസിയേഷൻ
പാഠം: അയോൺ എക്സ്ചേഞ്ച് പ്രതികരണങ്ങൾക്കുള്ള സമവാക്യങ്ങൾ എഴുതുക ഇരുമ്പ് (III) ഹൈഡ്രോക്സൈഡും നൈട്രിക് ആസിഡും തമ്മിലുള്ള പ്രതിപ്രവർത്തനത്തിന് നമുക്ക് ഒരു സമവാക്യം ഉണ്ടാക്കാം.
Fe(OH) 3 + 3HNO 3 = Fe(NO 3) 3 + 3H 2 O
(ഇരുമ്പ് (III) ഹൈഡ്രോക്സൈഡ് ഒരു ലയിക്കാത്ത അടിത്തറയാണ്, അതിനാൽ അത് വിധേയമല്ല. വെള്ളം മോശമായി വിഘടിപ്പിച്ച പദാർത്ഥമാണ്; ഇത് പ്രായോഗികമായി ലായനിയിൽ അയോണുകളായി വിഘടിക്കുന്നില്ല.)
Fe(OH) 3 + 3H + + 3NO 3 - = Fe 3+ + 3NO 3 - + 3H 2 O
ഇടത്തോട്ടും വലത്തോട്ടും ഒരേ എണ്ണം നൈട്രേറ്റ് അയോണുകൾ ക്രോസ് ചെയ്ത് ചുരുക്കിയ അയോണിക് സമവാക്യം എഴുതുക:
Fe(OH) 3 + 3H + = Fe 3+ + 3H 2 O
ഈ പ്രതികരണം പൂർത്തിയാകും, കാരണം ചെറുതായി വിഘടിപ്പിക്കാവുന്ന ഒരു പദാർത്ഥം രൂപം കൊള്ളുന്നു - വെള്ളം. സോഡിയം കാർബണേറ്റും മഗ്നീഷ്യം നൈട്രേറ്റും തമ്മിലുള്ള പ്രതിപ്രവർത്തനത്തിന് ഒരു സമവാക്യം എഴുതാം.
Na 2 CO 3 + Mg(NO 3) 2 = 2NaNO 3 + MgCO 3 ↓
നമുക്ക് ഈ സമവാക്യം അയോണിക് രൂപത്തിൽ എഴുതാം:
(മഗ്നീഷ്യം കാർബണേറ്റ് വെള്ളത്തിൽ ലയിക്കാത്തതിനാൽ അയോണുകളായി വിഘടിക്കുന്നില്ല.)
2Na + + CO 3 2- + Mg 2+ + 2NO 3 - = 2Na + + 2NO 3 - + MgCO 3 ↓
ഇടത്തും വലത്തും ഉള്ള അതേ എണ്ണം നൈട്രേറ്റ് അയോണുകളും സോഡിയം കാറ്റേഷനുകളും മറികടന്ന് ചുരുക്കിയ അയോണിക് സമവാക്യം എഴുതാം:
CO 3 2- + Mg 2+ = MgCO 3 ↓
ഈ പ്രതികരണം പൂർത്തിയാകും, കാരണം ഒരു അവശിഷ്ടം രൂപം കൊള്ളുന്നു - മഗ്നീഷ്യം കാർബണേറ്റ്. സോഡിയം കാർബണേറ്റും നൈട്രിക് ആസിഡും തമ്മിലുള്ള പ്രതിപ്രവർത്തനത്തിന് ഒരു സമവാക്യം എഴുതാം.
Na 2 CO 3 + 2HNO 3 = 2NaNO 3 + CO 2 + H 2 O
(കാർബൺ ഡൈ ഓക്സൈഡും വെള്ളവും ഫലമായി ഉണ്ടാകുന്ന ദുർബലമായ കാർബോണിക് ആസിഡിൻ്റെ വിഘടനത്തിൻ്റെ ഉൽപ്പന്നങ്ങളാണ്.)
2Na + + CO 3 2- + 2H + + 2NO 3 - = 2Na + + 2NO 3 - + CO 2 + H 2 O
CO 3 2- + 2H + = CO 2 + H 2 O
ഈ പ്രതികരണം പൂർത്തിയാകും, കാരണം തൽഫലമായി, വാതകം പുറത്തുവിടുകയും വെള്ളം രൂപപ്പെടുകയും ചെയ്യുന്നു. നമുക്ക് രണ്ട് തന്മാത്രാ പ്രതിപ്രവർത്തന സമവാക്യങ്ങൾ സൃഷ്ടിക്കാം, അത് ഇനിപ്പറയുന്ന ചുരുക്കിയ അയോണിക് സമവാക്യവുമായി പൊരുത്തപ്പെടുന്നു: Ca 2+ + CO 3 2- = CaCO 3 .
ചുരുക്കിയ അയോണിക് സമവാക്യം അയോൺ എക്സ്ചേഞ്ച് പ്രതിപ്രവർത്തനത്തിൻ്റെ സാരാംശം കാണിക്കുന്നു. IN ഈ സാഹചര്യത്തിൽകാൽസ്യം കാർബണേറ്റ് ലഭിക്കുന്നതിന്, ആദ്യത്തെ പദാർത്ഥത്തിൻ്റെ ഘടനയിൽ കാൽസ്യം കാറ്റേഷനുകളും രണ്ടാമത്തേതിൻ്റെ ഘടന - കാർബണേറ്റ് അയോണുകളും ഉൾപ്പെടുത്തേണ്ടത് ആവശ്യമാണെന്ന് നമുക്ക് പറയാം. നമുക്ക് കമ്പോസ് ചെയ്യാം തന്മാത്രാ സമവാക്യങ്ങൾഈ അവസ്ഥയെ തൃപ്തിപ്പെടുത്തുന്ന പ്രതികരണങ്ങൾ:
CaCl 2 + K 2 CO 3 = CaCO 3 ↓ + 2KCl
Ca(NO 3) 2 + Na 2 CO 3 = CaCO 3 ↓ + 2NaNO 3
1. ഒർഷെക്കോവ്സ്കി പി.എ. രസതന്ത്രം: ഒമ്പതാം ക്ലാസ്: പാഠപുസ്തകം. പൊതുവിദ്യാഭ്യാസത്തിന് സ്ഥാപനം / പി.എ. ഒർഷെക്കോവ്സ്കി, എൽ.എം. മെഷ്ചെര്യാക്കോവ, എൽ.എസ്. പോണ്ടക്. - എം.: AST: Astrel, 2007. (§17)
2. ഒർഷെക്കോവ്സ്കി പി.എ. രസതന്ത്രം: ഒമ്പതാം ക്ലാസ്: പൊതുവിദ്യാഭ്യാസം. സ്ഥാപനം / പി.എ. ഒർഷെക്കോവ്സ്കി, എൽ.എം. മെഷ്ചെര്യാക്കോവ, എം.എം. ഷാലശോവ. - എം.: ആസ്ട്രൽ, 2013. (§9)
3. റുഡ്സിറ്റിസ് ജി.ഇ. രസതന്ത്രം: അജൈവ. രസതന്ത്രം. അവയവം. രസതന്ത്രം: പാഠപുസ്തകം. 9-ാം ക്ലാസിന്. / ജി.ഇ. Rudzitis, F.G. ഫെൽഡ്മാൻ. - എം.: വിദ്യാഭ്യാസം, OJSC "മോസ്കോ പാഠപുസ്തകങ്ങൾ", 2009.
4. ഖോംചെങ്കോ ഐ.ഡി. രസതന്ത്രത്തിലെ പ്രശ്നങ്ങളുടെയും വ്യായാമങ്ങളുടെയും ശേഖരണം ഹൈസ്കൂൾ. - എം.: RIA "ന്യൂ വേവ്": പ്രസാധകൻ ഉമെരെൻകോവ്, 2008.
5. കുട്ടികൾക്കുള്ള എൻസൈക്ലോപീഡിയ. വാല്യം 17. രസതന്ത്രം / അധ്യായം. ed. വി.എ. വോലോഡിൻ, വേദ്. ശാസ്ത്രീയമായ ed. I. ലീൻസൺ. - എം.: അവന്ത+, 2003.
അധിക വെബ് ഉറവിടങ്ങൾ
1. ഡിജിറ്റൽ വിദ്യാഭ്യാസ വിഭവങ്ങളുടെ ഒരു ഏകീകൃത ശേഖരം (വിഷയത്തെക്കുറിച്ചുള്ള വീഡിയോ അനുഭവങ്ങൾ): ().
2. "രസതന്ത്രവും ജീവിതവും" ജേണലിൻ്റെ ഇലക്ട്രോണിക് പതിപ്പ്: ().
ഹോം വർക്ക്
1. പട്ടികയിൽ, അയോൺ എക്സ്ചേഞ്ച് പ്രതിപ്രവർത്തനങ്ങൾ സാധ്യമാകുന്ന പദാർത്ഥങ്ങളുടെ ജോഡികൾ ഒരു പ്ലസ് ചിഹ്നം ഉപയോഗിച്ച് അടയാളപ്പെടുത്തി പൂർത്തീകരണത്തിലേക്ക് പോകുക. പ്രതികരണ സമവാക്യങ്ങൾ തന്മാത്രാ, പൂർണ്ണവും കുറഞ്ഞതുമായ അയോണിക് രൂപത്തിൽ എഴുതുക.
|
പ്രതിപ്രവർത്തന പദാർത്ഥങ്ങൾ
|
കെ2
CO3
|
|
AgNO3
|
FeCl3
|
HNO3
|
|
|
|
|
|
|
|
|
CuCl2
|
|
|
|
|
|
|
|
|
|
|
|
|
2. പി. 67 നമ്പർ 10,13 പാഠപുസ്തകത്തിൽ നിന്ന് പി.എ. ഒർഷെക്കോവ്സ്കി "കെമിസ്ട്രി: 9 ഗ്രേഡ്" / പി.എ. ഒർഷെക്കോവ്സ്കി, എൽ.എം. മെഷ്ചെര്യാക്കോവ, എം.എം. ഷാലശോവ. - എം.: ആസ്ട്രൽ, 2013.
SO 4 2- + Ba 2+ → BaSO 4 ↓
അൽഗോരിതം:
ഒരു ന്യൂട്രൽ മോളിക്യൂൾ - ശക്തമായ ഇലക്ട്രോലൈറ്റ് ലഭിക്കുന്നതിന് സോളിബിലിറ്റി ടേബിൾ ഉപയോഗിച്ച് ഞങ്ങൾ ഓരോ അയോണിനും ഒരു കൌണ്ടർ അയോൺ തിരഞ്ഞെടുക്കുന്നു.
1. Na 2 SO 4 + BaCl 2 → 2 NaCl + BaSO 4
2. BaI 2 + K 2 SO 4 → 2KI + BaSO 4
3. Ba(NO 33) 2 + (NH 4) 2 SO 4 → 2 NH 4 NO 3 + BaSO 4
അയോണിക് സമ്പൂർണ്ണ സമവാക്യങ്ങൾ:
1. 2 Na + + SO 4 2- + Ba 2- + 2 Cl‾ → 2 Na + + 2 Cl‾ + BaSO 4
2. Ba 2+ + 2 I‾ + 2 K + + SO 4 2- → 2 K + + 2 I‾ + BaSO 4
3. Ba 2+ + 2 NO 3 ‾ + 2 NH 4 + + SO 4 2- → 2 NH 4 + + 2 NO 3 ‾ + BaSO 4
ഉപസംഹാരം:
ഒരു ചെറിയ സമവാക്യത്തിൽ പല തന്മാത്രാ സമവാക്യങ്ങളും എഴുതാം.
വിഷയം 9. ഉപ്പിൻ്റെ ഹൈഡ്രോലിസിസ്
ലവണങ്ങളുടെ ജലവിശ്ലേഷണം
- വെള്ളവുമായി ഉപ്പിൻ്റെ അയോൺ എക്സ്ചേഞ്ച് പ്രതിപ്രവർത്തനത്തിലേക്ക് നയിക്കുന്നു
ഗ്രീക്കിൽ നിന്ന് ദുർബലമായ ഇലക്ട്രോലൈറ്റിൻ്റെ രൂപീകരണത്തിലേക്ക് "ഹൈഡ്രോ" (അല്ലെങ്കിൽ
വെള്ളം, "ലിസിസ്" - ദുർബലമായ ബേസ് അല്ലെങ്കിൽ ദുർബലമായ ആസിഡ്) കൂടാതെ മാറ്റം-
പരിഹാര പരിസ്ഥിതിയെ ആശ്രയിച്ച് വിഘടിപ്പിക്കൽ.
ഏതെങ്കിലും ഉപ്പ് ഒരു അടിത്തറയുടെ പ്രതിപ്രവർത്തനത്തിൻ്റെ ഒരു ഉൽപ്പന്നമായി പ്രതിനിധീകരിക്കാം
ആസിഡ്.
|
|
|
|
|
|
ശക്തമായ ദുർബലമായ ശക്തമായ ദുർബലമായ രൂപപ്പെടാം
1. LiOH NH 4 OH അല്ലെങ്കിൽ 1. H 2 SO 4 എല്ലാം - 1. ശക്തമായ അടിത്തറയും
2. NaOH NH 3 · H 2 O 2. HNO 3 ദുർബലമായ ആസിഡുള്ള.
3. KOH മറ്റെല്ലാം - 3. HCl 2. ദുർബലമായ അടിത്തറയും
4. RbOH 4. HBr ശക്തമായ ആസിഡ്.
5. CsOH 5. HI 3. ദുർബലമായ അടിത്തറയും
6. FrOH 6. HClO 4 ദുർബലമായ ആസിഡ്.
7. Ca(OH) 2 4. ശക്തമായ അടിത്തറയും
8. Sr(OH) 2 ശക്തമായ ആസിഡ്.
9. Ba(OH) 2
അയോണിക്-മോളിക്യുലാർ ഹൈഡ്രോലിസിസ് സമവാക്യങ്ങളുടെ സമാഹാരം.
വിഷയത്തിലെ സാധാരണ പ്രശ്നങ്ങളുടെ പരിഹാരം: "ഉപ്പിൻ്റെ ഹൈഡ്രോലിസിസ്"
ടാസ്ക് നമ്പർ 1.
Na 2 CO 3 ലവണത്തിൻ്റെ ജലവിശ്ലേഷണത്തിനായി അയോൺ-തന്മാത്രാ സമവാക്യങ്ങൾ വരയ്ക്കുക.
അൽഗോരിതം ഉദാഹരണം
1. ഒരു ഡിസോ സമവാക്യം ഉണ്ടാക്കുക
ഉപ്പ് അയോണുകളായി മാറുന്നു. Na 2 CO 3 → 2Na + + CO 3 2- Na + → NaOH - ശക്തമായ
2. CO 3 2- →H 2 CO 3 എങ്ങനെ ദുർബലമാണെന്ന് വിശകലനം ചെയ്യുക
ബേസ്, എന്ത് അസിഡിറ്റി
അവിടെയാണ് ഉപ്പ് രൂപപ്പെടുന്നത്. ഉൽപ്പന്നം
3. ഏത് തരത്തിലുള്ള ജലവിശ്ലേഷണമാണെന്ന് നിഗമനം ചെയ്യുക
വെളുത്ത ഇലക്ട്രോലൈറ്റ് - ഉൽപ്പന്നം
ജലവിശ്ലേഷണം.
4. ഹൈഡ്രോലൈറ്റിക് സമവാക്യങ്ങൾ എഴുതുക
ഐ സ്റ്റേജ്.
A) ഒരു ചെറിയ അയോണിക് രചിക്കുക I. a) CO 3 2- + H + │OH ‾ HCO 3 ‾ + ഓ ‾
സമവാക്യം, പരിസ്ഥിതി നിർണ്ണയിക്കുക
പരിഹാരം. pH>7, ക്ഷാര പരിസ്ഥിതി
ബി) ഒരു സമ്പൂർണ്ണ അയോണിക് രൂപീകരിക്കുക b) 2Na + +CO 3 2- +HOH Na + +HCO 3 ‾ +Na + +OH ‾
സമവാക്യം, തന്മാത്രയാണെന്ന് അറിയുന്നത്
ലാ - വൈദ്യുത ന്യൂട്രൽ ചാ-
stitsa, എല്ലാവർക്കും വേണ്ടി എടുക്കുക
എതിർ അയോൺ.
ബി) ഒരു തന്മാത്ര ഉണ്ടാക്കുക c) Na 2 CO 3 + HOH NaHCO 3 + NaOH
ജലവിശ്ലേഷണ സമവാക്യം.
എങ്കിൽ ജലവിശ്ലേഷണം ഘട്ടം ഘട്ടമായി നടക്കുന്നു ദുർബലമായ അടിത്തറ- പോളിയാസിഡും ദുർബലമായ ആസിഡും - പോളിബേസിക്.
ഘട്ടം II (NHCO 3 Na + + HCO 3 ‾ ന് മുകളിലുള്ള അൽഗോരിതം കാണുക
1, 2, 3, 4a, 4b, 4c). II. a) HCO 3 ‾ + HOH H 2 CO 3 + OH ‾
B) Na + + HCO 3 ‾ H 2 CO 3 + Na + + OH ‾
B) NaHCO 3 + HOH H 2 CO 3 + NaOH
ഉപസംഹാരം:ശക്തമായ ബേസുകളും ദുർബല ആസിഡുകളും ചേർന്ന് രൂപം കൊള്ളുന്ന ലവണങ്ങൾ ഭാഗിക ജലവിശ്ലേഷണത്തിന് വിധേയമാകുന്നു (അയോണിൽ), പരിഹാര മാധ്യമം ആൽക്കലൈൻ ആണ് (pH>7).
ടാസ്ക് നമ്പർ 2.
ZnCl 2 ഉപ്പ് ജലവിശ്ലേഷണത്തിനായി അയോൺ-തന്മാത്രാ സമവാക്യങ്ങൾ വരയ്ക്കുക.
ZnCl 2 → Zn 2+ + 2 Cl ‾ Zn 2+ → Zn(OH) 2 - ദുർബലമായ അടിത്തറ
Cl ‾ → HCl - ശക്തമായ ആസിഡ്
I. a) Zn 2+ + H + /OH ‾ ZnOH + + H+അമ്ല അന്തരീക്ഷം, പി.എച്ച്<7
B) Zn 2+ + 2 Cl ‾ + HOH ZnOH + + Cl ‾ + H + + Cl ‾
B) ZnCl 2 + HOH ZnOHCl + HCl
II. a) ZnOH + + HOH Zn(OH) 2 + H +
B) ZnOH + + Cl ‾ + HOH Zn(OH) 2 + H + + Cl ‾
B) ZnOHCl + HOH Zn(OH) 2 + HCl
ഉപസംഹാരം:ദുർബലമായ ബേസുകളും ശക്തമായ ആസിഡുകളും ചേർന്ന് രൂപം കൊള്ളുന്ന ലവണങ്ങൾ ഭാഗിക ജലവിശ്ലേഷണത്തിന് വിധേയമാകുന്നു (കാറ്റേഷൻ വഴി), ലായനി മാധ്യമം അമ്ലമാണ്.
ടാസ്ക് നമ്പർ 3.
Al 2 S 3 ഉപ്പ് ജലവിശ്ലേഷണത്തിനായി അയോൺ-തന്മാത്രാ സമവാക്യങ്ങൾ വരയ്ക്കുക.
Al 2 S 3 → 2 Al 3+ + 3 S 2- Al 3+ → Al(OH) 3 - ദുർബലമായ അടിത്തറ
S 2- → H 2 S - ദുർബലമായ ആസിഡ്
a), b) 2 Al 3+ + 3 S 2- + 6 HOH → 2 Al(OH) 3 ↓ + 3 H 2 S
c) Al 2 S 3 + 6 H 2 O → 2 Al(OH) 3 + 3 H 2S S
ഉപസംഹാരം:ദുർബലമായ ബേസുകളും ദുർബല ആസിഡുകളും ചേർന്ന് രൂപം കൊള്ളുന്ന ലവണങ്ങൾ പൂർണ്ണമായ (മാറ്റാനാവാത്ത) ജലവിശ്ലേഷണത്തിന് വിധേയമാകുന്നു, ലായനി മാധ്യമം നിഷ്പക്ഷതയ്ക്ക് അടുത്താണ്.
ഏതെങ്കിലും ശക്തമായ ആസിഡിനെ ഏതെങ്കിലും ശക്തമായ അടിത്തറയാൽ നിർവീര്യമാക്കുമ്പോൾ, രൂപം കൊള്ളുന്ന ഓരോ മോളിലെയും താപം പുറത്തുവിടുന്നു:
അത്തരം പ്രതികരണങ്ങൾ ഒരു പ്രക്രിയയിലേക്ക് ചുരുങ്ങുന്നുവെന്ന് ഇത് സൂചിപ്പിക്കുന്നു. നൽകിയിരിക്കുന്ന പ്രതികരണങ്ങളിൽ ഒന്ന് കൂടുതൽ വിശദമായി പരിഗണിക്കുകയാണെങ്കിൽ, ഈ പ്രക്രിയയ്ക്കുള്ള സമവാക്യം നമുക്ക് ലഭിക്കും, ഉദാഹരണത്തിന്, ആദ്യത്തേത്. അതിൻ്റെ സമവാക്യം മാറ്റി എഴുതാം, ശക്തമായ ഇലക്ട്രോലൈറ്റുകൾ അയോണിക് രൂപത്തിൽ എഴുതുന്നു, കാരണം അവ അയോണുകളുടെ രൂപത്തിലും ദുർബലമായ ഇലക്ട്രോലൈറ്റുകൾ തന്മാത്രാ രൂപത്തിലും നിലനിൽക്കുന്നതിനാൽ, അവ പ്രധാനമായും തന്മാത്രകളുടെ രൂപത്തിലാണ് (വെള്ളം വളരെ ദുർബലമായ ഇലക്ട്രോലൈറ്റാണ്, കാണുക. § 90):
തത്ഫലമായുണ്ടാകുന്ന സമവാക്യം കണക്കിലെടുക്കുമ്പോൾ, പ്രതിപ്രവർത്തന സമയത്ത് അയോണുകൾ മാറ്റങ്ങൾക്ക് വിധേയമായിട്ടില്ലെന്ന് നമുക്ക് കാണാം. അതിനാൽ, സമവാക്യത്തിൻ്റെ ഇരുവശത്തുനിന്നും ഈ അയോണുകൾ ഒഴിവാക്കിക്കൊണ്ട് ഞങ്ങൾ സമവാക്യം വീണ്ടും എഴുതും. നമുക്ക് ലഭിക്കുന്നത്:
അങ്ങനെ, ഏതെങ്കിലും ശക്തമായ അടിത്തറയുള്ള ഏതെങ്കിലും ശക്തമായ ആസിഡിൻ്റെ ന്യൂട്രലൈസേഷൻ്റെ പ്രതികരണങ്ങൾ ഒരേ പ്രക്രിയയിലേക്ക് വരുന്നു - ഹൈഡ്രജൻ അയോണുകളിൽ നിന്നും ഹൈഡ്രോക്സൈഡ് അയോണുകളിൽ നിന്നും ജല തന്മാത്രകളുടെ രൂപീകരണം. ഈ പ്രതിപ്രവർത്തനങ്ങളുടെ താപ ഫലങ്ങളും സമാനമായിരിക്കണമെന്ന് വ്യക്തമാണ്.
കൃത്യമായി പറഞ്ഞാൽ, അയോണുകളിൽ നിന്നുള്ള ജലത്തിൻ്റെ രൂപീകരണത്തിൻ്റെ പ്രതിപ്രവർത്തനം റിവേഴ്സിബിൾ ആണ്, ഇത് സമവാക്യം ഉപയോഗിച്ച് പ്രകടിപ്പിക്കാം.
എന്നിരുന്നാലും, നമ്മൾ താഴെ കാണുന്നത് പോലെ, വെള്ളം വളരെ ദുർബലമായ ഇലക്ട്രോലൈറ്റാണ്, മാത്രമല്ല അത് വളരെ ചെറിയ അളവിൽ മാത്രം വിഘടിപ്പിക്കുകയും ചെയ്യുന്നു. മറ്റൊരു വിധത്തിൽ പറഞ്ഞാൽ, ജല തന്മാത്രകളും അയോണുകളും തമ്മിലുള്ള സന്തുലിതാവസ്ഥ തന്മാത്രകളുടെ രൂപീകരണത്തിലേക്ക് ശക്തമായി മാറുന്നു. അതിനാൽ, പ്രായോഗികമായി, ശക്തമായ അടിത്തറയുള്ള ശക്തമായ ആസിഡിൻ്റെ ന്യൂട്രലൈസേഷൻ്റെ പ്രതികരണം പൂർത്തിയാകും.
ഹൈഡ്രോക്ലോറിക് ആസിഡുമായോ അതിൻ്റെ ഏതെങ്കിലും ലവണങ്ങളുടെ ലായനിയുമായോ ഏതെങ്കിലും വെള്ളി ലവണത്തിൻ്റെ ഒരു ലായനി കലർത്തുമ്പോൾ, സിൽവർ ക്ലോറൈഡിൻ്റെ ഒരു വെളുത്ത ചീസി അവശിഷ്ടം എല്ലായ്പ്പോഴും രൂപം കൊള്ളുന്നു:

അത്തരം പ്രതികരണങ്ങളും ഒരു പ്രക്രിയയിലേക്ക് വരുന്നു. അതിൻ്റെ അയോണിക്-മോളിക്യുലർ സമവാക്യം ലഭിക്കുന്നതിന്, ഞങ്ങൾ ആദ്യത്തെ പ്രതിപ്രവർത്തനത്തിൻ്റെ സമവാക്യം തിരുത്തിയെഴുതുന്നു, മുമ്പത്തെ ഉദാഹരണത്തിലെന്നപോലെ ശക്തമായ ഇലക്ട്രോലൈറ്റുകൾ എഴുതുന്നു, അയോണിക് രൂപത്തിൽ, അവശിഷ്ടത്തിലെ പദാർത്ഥം തന്മാത്രാ രൂപത്തിൽ:
കാണാൻ കഴിയുന്നതുപോലെ, പ്രതികരണ സമയത്ത് അയോണുകൾ മാറ്റങ്ങൾക്ക് വിധേയമാകുന്നില്ല. അതിനാൽ, ഞങ്ങൾ അവയെ ഒഴിവാക്കുകയും സമവാക്യം വീണ്ടും എഴുതുകയും ചെയ്യുന്നു:
പരിഗണനയിലുള്ള പ്രക്രിയയുടെ അയോൺ-തന്മാത്രാ സമവാക്യമാണിത്.
സിൽവർ ക്ലോറൈഡ് അവശിഷ്ടം ലായനിയിലെ അയോണുകളുമായി സന്തുലിതാവസ്ഥയിലാണെന്നും അവസാന സമവാക്യം പ്രകടിപ്പിക്കുന്ന പ്രക്രിയ പഴയപടിയാക്കാമെന്നും ഇവിടെ നാം ഓർക്കണം:
എന്നിരുന്നാലും, സിൽവർ ക്ലോറൈഡിൻ്റെ കുറഞ്ഞ ലയിക്കുന്നതിനാൽ, ഈ സന്തുലിതാവസ്ഥ വളരെ ശക്തമായി വലതുവശത്തേക്ക് മാറ്റുന്നു. അതിനാൽ, അയോണുകളിൽ നിന്നുള്ള രൂപീകരണത്തിൻ്റെ പ്രതികരണം ഏതാണ്ട് പൂർത്തിയായതായി നമുക്ക് അനുമാനിക്കാം.
ഒരു ലായനിയിൽ കാര്യമായ സാന്ദ്രതയും അയോണുകളും ഉള്ളപ്പോൾ ഒരു അവശിഷ്ടത്തിൻ്റെ രൂപീകരണം എല്ലായ്പ്പോഴും നിരീക്ഷിക്കപ്പെടും. അതിനാൽ, സിൽവർ അയോണുകളുടെ സഹായത്തോടെ ഒരു ലായനിയിൽ അയോണുകളുടെ സാന്നിധ്യം കണ്ടുപിടിക്കാൻ സാധിക്കും, നേരെമറിച്ച്, ക്ലോറൈഡ് അയോണുകളുടെ സഹായത്തോടെ - വെള്ളി അയോണുകളുടെ സാന്നിധ്യം; ഒരു അയോണിന് ഒരു അയോണിൽ ഒരു പ്രതിപ്രവർത്തനമായും ഒരു അയോണിന് ഒരു അയോണിൽ ഒരു പ്രതിപ്രവർത്തനമായും പ്രവർത്തിക്കാൻ കഴിയും.
ഭാവിയിൽ, ഇലക്ട്രോലൈറ്റുകൾ ഉൾപ്പെടുന്ന പ്രതിപ്രവർത്തനങ്ങൾക്കായി ഞങ്ങൾ സമവാക്യങ്ങൾ എഴുതുന്നതിനുള്ള അയോണിക്-തന്മാത്രാ രൂപം വ്യാപകമായി ഉപയോഗിക്കും.
അയോൺ-തന്മാത്രാ സമവാക്യങ്ങൾ വരയ്ക്കുന്നതിന്, ഏത് ലവണങ്ങളാണ് വെള്ളത്തിൽ ലയിക്കുന്നതെന്നും പ്രായോഗികമായി ലയിക്കാത്തവയാണെന്നും നിങ്ങൾ അറിയേണ്ടതുണ്ട്. ജലത്തിലെ ഏറ്റവും പ്രധാനപ്പെട്ട ലവണങ്ങളുടെ ലയിക്കുന്നതിൻ്റെ പൊതു സവിശേഷതകൾ പട്ടികയിൽ നൽകിയിരിക്കുന്നു. 15.
പട്ടിക 15. ജലത്തിലെ ഏറ്റവും പ്രധാനപ്പെട്ട ലവണങ്ങളുടെ ലയനം

ഇലക്ട്രോലൈറ്റുകൾ തമ്മിലുള്ള പ്രതിപ്രവർത്തനങ്ങളുടെ സവിശേഷതകൾ മനസ്സിലാക്കാൻ അയോണിക്-തന്മാത്രാ സമവാക്യങ്ങൾ സഹായിക്കുന്നു. ഒരു ഉദാഹരണമായി, ദുർബലമായ ആസിഡുകളുടെയും ബേസുകളുടെയും പങ്കാളിത്തത്തോടെ സംഭവിക്കുന്ന നിരവധി പ്രതികരണങ്ങൾ നമുക്ക് പരിഗണിക്കാം.
ഇതിനകം സൂചിപ്പിച്ചതുപോലെ, ഏതെങ്കിലും ശക്തമായ ആസിഡിനെ ഏതെങ്കിലും ശക്തമായ അടിത്തറ ഉപയോഗിച്ച് നിർവീര്യമാക്കുന്നത് ഒരേ താപ പ്രഭാവത്തോടൊപ്പമുണ്ട്, കാരണം ഇത് ഒരേ പ്രക്രിയയിലേക്ക് വരുന്നു - ഹൈഡ്രജൻ അയോണുകളിൽ നിന്നും ഹൈഡ്രോക്സൈഡ് അയോണുകളിൽ നിന്നും ജല തന്മാത്രകളുടെ രൂപീകരണം.
എന്നിരുന്നാലും, ബലഹീനമായ അടിത്തറയുള്ള ശക്തമായ ആസിഡിനെ നിർവീര്യമാക്കുമ്പോൾ, അല്ലെങ്കിൽ ബലഹീനമായ അല്ലെങ്കിൽ ദുർബലമായ അടിത്തറയുള്ള ദുർബലമായ ആസിഡിനെ നിർവീര്യമാക്കുമ്പോൾ, താപ ഫലങ്ങൾ വ്യത്യസ്തമായിരിക്കും. അത്തരം പ്രതിപ്രവർത്തനങ്ങൾക്ക് നമുക്ക് അയോൺ-മോളിക്യുലർ സമവാക്യങ്ങൾ എഴുതാം.
ശക്തമായ അടിത്തറയുള്ള (സോഡിയം ഹൈഡ്രോക്സൈഡ്) ദുർബലമായ ആസിഡിൻ്റെ (അസറ്റിക് ആസിഡ്) ന്യൂട്രലൈസേഷൻ:
ഇവിടെ, ശക്തമായ ഇലക്ട്രോലൈറ്റുകൾ സോഡിയം ഹൈഡ്രോക്സൈഡും തത്ഫലമായുണ്ടാകുന്ന ഉപ്പും ആണ്, ദുർബലമായ ഇലക്ട്രോലൈറ്റുകൾ ആസിഡും വെള്ളവുമാണ്:
കാണാനാകുന്നതുപോലെ, പ്രതികരണ സമയത്ത് സോഡിയം അയോണുകൾ മാത്രം മാറ്റങ്ങൾക്ക് വിധേയമാകുന്നില്ല. അതിനാൽ, അയോൺ-തന്മാത്രാ സമവാക്യത്തിന് ഒരു രൂപമുണ്ട്:
ദുർബലമായ അടിത്തറയുള്ള (അമോണിയം ഹൈഡ്രോക്സൈഡ്) ശക്തമായ ആസിഡിൻ്റെ (നൈട്രജൻ) ന്യൂട്രലൈസേഷൻ:
ഇവിടെ നമ്മൾ ആസിഡും തത്ഫലമായുണ്ടാകുന്ന ഉപ്പും അയോണുകളുടെ രൂപത്തിലും അമോണിയം ഹൈഡ്രോക്സൈഡും വെള്ളവും തന്മാത്രകളുടെ രൂപത്തിലും എഴുതണം:
അയോണുകൾ മാറ്റങ്ങൾക്ക് വിധേയമാകുന്നില്ല. അവ ഒഴിവാക്കി, നമുക്ക് അയോണിക്-തന്മാത്രാ സമവാക്യം ലഭിക്കും:
ദുർബലമായ ആസിഡിൻ്റെ (അസറ്റിക് ആസിഡ്) ദുർബലമായ അടിത്തറയുള്ള (അമോണിയം ഹൈഡ്രോക്സൈഡ്) നിർവീര്യമാക്കൽ:
ഈ പ്രതിപ്രവർത്തനത്തിൽ, രൂപംകൊണ്ടവ ഒഴികെയുള്ള എല്ലാ പദാർത്ഥങ്ങളും ദുർബലമായ ഇലക്ട്രോലൈറ്റുകളാണ്. അതിനാൽ, സമവാക്യത്തിൻ്റെ അയോൺ-തന്മാത്രാ രൂപം ഇതുപോലെ കാണപ്പെടുന്നു:
ലഭിച്ച അയോൺ-തന്മാത്രാ സമവാക്യങ്ങൾ പരസ്പരം താരതമ്യം ചെയ്യുമ്പോൾ, അവയെല്ലാം വ്യത്യസ്തമാണെന്ന് നമുക്ക് കാണാം. അതിനാൽ, പരിഗണിക്കപ്പെടുന്ന പ്രതിപ്രവർത്തനങ്ങളുടെ ഹീറ്റുകളും വ്യത്യസ്തമാണെന്ന് വ്യക്തമാണ്.
ഇതിനകം സൂചിപ്പിച്ചതുപോലെ, ഹൈഡ്രജൻ അയോണുകളും ഹൈഡ്രോക്സൈഡ് അയോണുകളും സംയോജിച്ച് ഒരു ജല തന്മാത്രയായി മാറുന്ന ശക്തമായ ആസിഡുകളുടെ നിർവീര്യമാക്കൽ പ്രതികരണങ്ങൾ ഏതാണ്ട് പൂർത്തിയാകും. പ്രാരംഭ പദാർത്ഥങ്ങളിലൊന്നെങ്കിലും ദുർബലമായ ഇലക്ട്രോലൈറ്റ് ആയ ന്യൂട്രലൈസേഷൻ പ്രതിപ്രവർത്തനങ്ങൾ, അയോൺ-മോളിക്യുലർ സമവാക്യത്തിൻ്റെ വലതുവശത്ത് മാത്രമല്ല, ഇടതുവശത്തും ദുർബലമായി ബന്ധപ്പെട്ട പദാർത്ഥങ്ങളുടെ തന്മാത്രകൾ അടങ്ങിയിരിക്കുന്നു, അവ പൂർത്തിയാകുന്നില്ല. .
അവ സന്തുലിതാവസ്ഥയിലെത്തുന്നു, അതിൽ ഉപ്പ് രൂപംകൊണ്ട ആസിഡും ബേസും ചേർന്ന് നിലകൊള്ളുന്നു. അതിനാൽ, അത്തരം പ്രതിപ്രവർത്തനങ്ങളുടെ സമവാക്യങ്ങൾ റിവേഴ്സിബിൾ റിയാക്സുകളായി എഴുതുന്നതാണ് കൂടുതൽ ശരി.
നിർദ്ദേശങ്ങൾ
ഒരു മിതമായി ലയിക്കുന്ന സംയുക്തത്തിൻ്റെ രൂപീകരണത്തിൻ്റെ ഒരു ഉദാഹരണം പരിഗണിക്കുക.
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
അല്ലെങ്കിൽ ഒരു അയോണിക് പതിപ്പ്:
2Na+ +SO42- +Ba2++ 2Cl- = BaSO4 + 2Na+ + 2Cl-
അയോണിക് സമവാക്യങ്ങൾ പരിഹരിക്കുമ്പോൾ, ഇനിപ്പറയുന്ന നിയമങ്ങൾ പാലിക്കണം:
രണ്ട് ഭാഗങ്ങളിൽ നിന്നും സമാനമായ അയോണുകൾ ഒഴിവാക്കിയിരിക്കുന്നു;
സമവാക്യത്തിൻ്റെ ഇടതുവശത്തുള്ള വൈദ്യുത ചാർജുകളുടെ ആകെത്തുക സമവാക്യത്തിൻ്റെ വലതുവശത്തുള്ള വൈദ്യുത ചാർജുകളുടെ ആകെത്തുകയ്ക്ക് തുല്യമായിരിക്കണം എന്നത് ഓർമ്മിക്കേണ്ടതാണ്.
ഇനിപ്പറയുന്ന പദാർത്ഥങ്ങളുടെ ജലീയ ലായനികൾ തമ്മിലുള്ള പ്രതിപ്രവർത്തനത്തിനായി അയോണിക് സമവാക്യങ്ങൾ എഴുതുക: a) HCl, NaOH; b) AgNO3 ഉം NaCl ഉം; സി) K2CO3, H2SO4; d) CH3COOH ഉം NaOH ഉം.
പരിഹാരം. ഈ പദാർത്ഥങ്ങളുടെ പ്രതിപ്രവർത്തനത്തിൻ്റെ സമവാക്യങ്ങൾ തന്മാത്രാ രൂപത്തിൽ എഴുതുക:
a) HCl + NaOH = NaCl + H2O
b) AgNO3 + NaCl = AgCl + NaNO3
c) K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
d) CH3COOH + NaOH = CH3COONa + H2O
ഈ പദാർത്ഥങ്ങളുടെ പ്രതിപ്രവർത്തനം സാധ്യമാണെന്ന് ശ്രദ്ധിക്കുക, കാരണം ദുർബലമായ (H2O), അല്ലെങ്കിൽ വളരെ കുറച്ച് ലയിക്കുന്ന പദാർത്ഥം (AgCl), അല്ലെങ്കിൽ വാതകം (CO2) എന്നിവയുടെ രൂപീകരണവുമായി അയോണുകളെ ബന്ധിപ്പിക്കുന്നതാണ് ഫലം.
സമത്വത്തിൻ്റെ ഇടതും വലതും വശങ്ങളിൽ നിന്ന് സമാനമായ അയോണുകൾ ഒഴിവാക്കുന്നതിലൂടെ (ഓപ്ഷൻ എയുടെ കാര്യത്തിൽ) - അയോണുകളും , ബി ആണെങ്കിൽ) - സോഡിയം അയോണുകളും -അയോണുകളും, കേസിൽ സി) - പൊട്ടാസ്യം അയോണുകളും സൾഫേറ്റ് അയോണുകളും), d) - സോഡിയം അയോണുകൾ, നിങ്ങൾക്ക് ഈ അയോണിക് സമവാക്യങ്ങൾ പരിഹരിക്കാൻ കഴിയും:
a) H+ + OH- = H2O
b) Ag+ + Cl- = AgCl
c) CO32- + 2H+ = CO2 + H2O
d) CH3COOH + OH- = CH3COO- + H2O
പലപ്പോഴും സ്വതന്ത്രവും പരീക്ഷണാത്മകവുമായ ജോലികളിൽ പ്രതികരണ സമവാക്യങ്ങൾ പരിഹരിക്കുന്നതിൽ ഉൾപ്പെടുന്ന ജോലികൾ ഉണ്ട്. എന്നിരുന്നാലും, ചില അറിവുകളും കഴിവുകളും കഴിവുകളും ഇല്ലാതെ, ഏറ്റവും ലളിതമായ രാസവസ്തു പോലും സമവാക്യങ്ങൾഎഴുതരുത്.
നിർദ്ദേശങ്ങൾ
ഒന്നാമതായി, നിങ്ങൾ അടിസ്ഥാന ജൈവ, അജൈവ സംയുക്തങ്ങൾ പഠിക്കേണ്ടതുണ്ട്. അവസാന ആശ്രയമെന്ന നിലയിൽ, ടാസ്ക് സമയത്ത് സഹായിക്കാൻ കഴിയുന്ന അനുയോജ്യമായ ഒരു ചീറ്റ് ഷീറ്റ് നിങ്ങളുടെ മുൻപിലുണ്ടാകും. പരിശീലനത്തിനു ശേഷം, ആവശ്യമായ അറിവും കഴിവുകളും ഇപ്പോഴും നിങ്ങളുടെ മെമ്മറിയിൽ സൂക്ഷിക്കും.
അടിസ്ഥാന മെറ്റീരിയൽ കവർ ചെയ്യുന്നു, അതുപോലെ ഓരോ സംയുക്തം നേടുന്നതിനുള്ള രീതികളും. അവ സാധാരണയായി പൊതുവായ ഡയഗ്രമുകളുടെ രൂപത്തിലാണ് അവതരിപ്പിക്കുന്നത്, ഉദാഹരണത്തിന്: 1. + ബേസ് = ഉപ്പ് + വെള്ളം
2. ആസിഡ് ഓക്സൈഡ് + ബേസ് = ഉപ്പ് + വെള്ളം
3. അടിസ്ഥാന ഓക്സൈഡ് + ആസിഡ് = ഉപ്പ് + വെള്ളം
4. ലോഹം + (നേർപ്പിച്ച) ആസിഡ് = ഉപ്പ് + ഹൈഡ്രജൻ
5. ലയിക്കുന്ന ഉപ്പ് + ലയിക്കുന്ന ഉപ്പ് = ലയിക്കാത്ത ഉപ്പ് + ലയിക്കുന്ന ഉപ്പ്
6. ലയിക്കുന്ന ഉപ്പ് + = ലയിക്കാത്ത അടിസ്ഥാനം + ലയിക്കുന്ന ഉപ്പ്
ലവണങ്ങളുടെ ലയിക്കുന്നതിൻ്റെ ഒരു പട്ടിക നിങ്ങളുടെ കണ്ണുകൾക്ക് മുമ്പിലുണ്ട്, കൂടാതെ ചീറ്റ് ഷീറ്റുകളും നിങ്ങൾക്ക് അവയിൽ തീരുമാനിക്കാം. സമവാക്യങ്ങൾപ്രതികരണങ്ങൾ. അത്തരം സ്കീമുകളുടെ പൂർണ്ണമായ ലിസ്റ്റും വിവിധ തരം ഓർഗാനിക്, അജൈവ സംയുക്തങ്ങളുടെ സൂത്രവാക്യങ്ങളെയും പേരുകളെയും കുറിച്ചുള്ള വിവരങ്ങളും ഉണ്ടായിരിക്കേണ്ടത് പ്രധാനമാണ്.
സമവാക്യം തന്നെ പൂർത്തിയാക്കിയ ശേഷം, കെമിക്കൽ ഫോർമുലകളുടെ ശരിയായ അക്ഷരവിന്യാസം പരിശോധിക്കേണ്ടത് ആവശ്യമാണ്. ആസിഡുകൾ, ലവണങ്ങൾ, ബേസുകൾ എന്നിവ അസിഡിക് അവശിഷ്ടങ്ങളുടെയും ലോഹ അയോണുകളുടെയും ചാർജുകൾ കാണിക്കുന്ന സോളിബിലിറ്റി ടേബിൾ ഉപയോഗിച്ച് എളുപ്പത്തിൽ പരിശോധിക്കുന്നു. ഏതൊരു വ്യക്തിയും പൊതുവെ വൈദ്യുതപരമായി നിഷ്പക്ഷമായിരിക്കണം എന്നത് ഓർത്തിരിക്കേണ്ടത് പ്രധാനമാണ്, അതായത്, പോസിറ്റീവ് ചാർജുകളുടെ എണ്ണം നെഗറ്റീവ് ചാർജുകളുടെ എണ്ണവുമായി പൊരുത്തപ്പെടണം. ഈ സാഹചര്യത്തിൽ, അനുബന്ധ ചാർജുകൾ കൊണ്ട് ഗുണിച്ച സൂചികകൾ കണക്കിലെടുക്കേണ്ടത് ആവശ്യമാണ്.
ഈ ഘട്ടം കടന്നുപോകുകയും അക്ഷരവിന്യാസത്തിൻ്റെ കൃത്യതയിൽ നിങ്ങൾക്ക് ആത്മവിശ്വാസമുണ്ടെങ്കിൽ സമവാക്യങ്ങൾരാസവസ്തു പ്രതികരണങ്ങൾ, അപ്പോൾ നിങ്ങൾക്ക് ഇപ്പോൾ സുരക്ഷിതമായി ഗുണകങ്ങൾ സജ്ജമാക്കാൻ കഴിയും. കെമിക്കൽ സമവാക്യം പരമ്പരാഗത നൊട്ടേഷൻ പ്രതിനിധീകരിക്കുന്നു പ്രതികരണങ്ങൾരാസ ചിഹ്നങ്ങളും സൂചികകളും ഗുണകങ്ങളും ഉപയോഗിക്കുന്നു. ചുമതലയുടെ ഈ ഘട്ടത്തിൽ, നിങ്ങൾ നിയമങ്ങൾ പാലിക്കണം: കോഫിഫിഷ്യൻ്റ് കെമിക്കൽ ഫോർമുലയ്ക്ക് മുന്നിൽ സ്ഥാപിക്കുകയും പദാർത്ഥം നിർമ്മിക്കുന്ന എല്ലാ മൂലകങ്ങൾക്കും ബാധകമാവുകയും ചെയ്യുന്നു.
സൂചിക രാസ മൂലകത്തിന് ശേഷം അല്പം താഴെയായി സ്ഥാപിക്കുന്നു, അതിൻ്റെ ഇടതുവശത്തുള്ള രാസ മൂലകത്തെ മാത്രം സൂചിപ്പിക്കുന്നു.
ഒരു ഗ്രൂപ്പ് (ഉദാഹരണത്തിന്, ഒരു ആസിഡ് അവശിഷ്ടം അല്ലെങ്കിൽ ഒരു ഹൈഡ്രോക്സൈൽ ഗ്രൂപ്പ്) ബ്രാക്കറ്റിലാണെങ്കിൽ, അടുത്തുള്ള രണ്ട് സൂചികകൾ (ബ്രാക്കറ്റിന് മുമ്പും ശേഷവും) ഗുണിച്ചിട്ടുണ്ടെന്ന് നിങ്ങൾ മനസ്സിലാക്കേണ്ടതുണ്ട്.
ഒരു രാസ മൂലകത്തിൻ്റെ ആറ്റങ്ങൾ കണക്കാക്കുമ്പോൾ, ഗുണകം സൂചികയാൽ ഗുണിക്കുന്നു (ചേർക്കുന്നില്ല!).
അടുത്തതായി, ഓരോ രാസ മൂലകത്തിൻ്റെയും അളവ് കണക്കാക്കുന്നു, അതിനാൽ ആരംഭ പദാർത്ഥങ്ങളിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന മൂലകങ്ങളുടെ എണ്ണം ഉൽപ്പന്നങ്ങളിൽ രൂപം കൊള്ളുന്ന സംയുക്തങ്ങളിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന ആറ്റങ്ങളുടെ എണ്ണവുമായി പൊരുത്തപ്പെടുന്നു. പ്രതികരണങ്ങൾ. മേൽപ്പറഞ്ഞ നിയമങ്ങൾ വിശകലനം ചെയ്ത് പ്രയോഗിക്കുന്നതിലൂടെ, നിങ്ങൾക്ക് പരിഹരിക്കാൻ പഠിക്കാം സമവാക്യങ്ങൾപദാർത്ഥങ്ങളുടെ ശൃംഖലയിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന പ്രതികരണങ്ങൾ.