Odseki spletnega mesta
Izbira urednikov:
- Kako povezati alarm: funkcije namestitve, diagram in priporočila
- Odličen način izdelave mehanskih rok pošasti z lastnimi rokami Kovinske obrti: plošča - ribe
- DIY predilna cev - nekaj praktičnih možnosti
- Naredite sekiro (67 fotografij) - ustvarite bojno, dekorativno in delovno orodje
- Naredite sami PVC periskop iz PVC cevi
- Kaj je mogoče narediti s vžigalnikom: izvirne ideje Kaj si lahko omislite od starih vžigalnikov
- Papirni respirator omogoča preprostejše možnosti za domačo plinsko masko
- Kako položiti temelje. Gradbeni življenjski kramp. Pravi kot - kako izračunati razpoložljiva sredstva Kako poravnati kot stene
- Sušenje in žganje oborine
- DIY ciklonski filter
Oglaševanje
| Kaj je kalcinacija. Sušenje in žganje oborine. Tehtanje. Naloge C2 iz možnosti izpitov iz kemije za samostojno delo |
|
Ta lekcija je praktična lekcija, med katero se izvajajo različni poskusi, ki so fizični in kemični procesi. Izvedene kemijske reakcije imajo lastnosti, ki označujejo pogoje za nastanek in potek reakcij ter njihove znake. Zadeva: Začetni kemijski pojmi Lekcija: Vadba 3. Kemijske reakcije IZKUŠNJE 1. Košček parafina se postavi na kovinsko ploščo in segreva. Kot rezultat opazimo spremembo agregacije parafina (prehod v tekoče stanje). Kljub temu, da je staljeni parafin postal brezbarven (barva se je spremenila), se ta pojav nanaša na fizično, ker sestava snovi je ostala enaka, spremenilo se je le njeno agregatno stanje.
Sl. 1. parafinski vosek DOŽIVETJE 2. Prižgemo svečo in pustimo, da malo gori. Med prižigom sveče gorijo stenj in parafin, del parafina se topi, segreva se iz toplote, ki nastane med zgorevanjem. Izgorevanje stenja in parafina je kemični proces, ker začetni materiali se pretvorijo v nove reakcijske produkte. Ti izdelki so plinasti, ker sveča je zmanjšana v velikosti. Izgorevanje spremlja sproščanje toplote in svetlobe. Taljenje parafina se, kot je že omenjeno, nanaša na fizikalne pojave. Karakteriziramo postopek prižiganja sveče. Pogoji za začetek reakcije so požig in stik stena z zrakom. Pogoj za reakcijo je dotok svežega zraka (če ga ustavimo, bo sveča ugasnila). Znaki reakcije so sproščanje toplote in svetlobe.
2. Elektronska različica časopisa "Kemija in življenje" (). Domača naloga s .14-15 №№ 9, 10 iz delovnega zvezka iz kemije: 8. razred: do učbenika P.A. Orzhekovsky in drugi. "Kemija. 8. razred ”/ O.V. Ušakova, P.I. Bespalov, P.A. Oržekovski; pod. ed. prof. P.A. Orzhekovsky - M .: AST: Astrel: Profizdat, 2006. "Snov in energija" - ogljikovi hidrati. Reši našo naravo. Zakaj živali jedo? Naredite spletno hrano. Znaki živega organizma. Družina sita poleti poje 35 tisoč gosenic. Kisik Starcu ni bilo všeč, kako je Sova hitela in vzdihovala. Sipa. Dedek je takoj potrkal in ptičje glasove. Sestavite prehransko verigo. Trava. Maščobe. Hladnokrvni. "Lastnosti žive snovi" - Razmišljanje: Ravni organizacije življenja: Merila življenja: Proučevanje nove teme. Zakaj obstaja veliko pojmov "ŽIVLJENJE", ni pa niti enega kratkega in splošno sprejetega? Kako so lastnosti bivanja na različnih ravneh organizacije? Označite glavne značilnosti koncepta "Biološki sistem". Organizacijski trenutek. „Količina snovi“ - Molska masa je številčno enaka relativni molekulski masi snovi. Koliko strukturnih enot je v enem molu? Epigraf. 1. V merilni valj izmerite 12 žlic vode. Izmerjeno g \\ mol. Prikaže maso 1 mol snovi. Lekcija - raziskava: »Količina snovi. Ima številčno vrednost 6.021023. "Snov" - Trenutno je znanih nekaj več kot sto vrst atomov. In če ni oblakov, ampak sije sonce? Naredite ustrezne zaključke. Holding. V slovarju poiščite razlago pojma "ekstrakcija". Na enak način (z izjemo!) Izhlapite 3-4 ml sladkorne raztopine. Na Zemlji skoraj nikoli ne naletite na fizikalne snovi. "Snov v kemiji" - Plinaste snovi. Kemična. Aceton Ogljikov dioksid. Sposobnost reakcije z drugimi snovmi. Fizično. Izberite pravo besedo. Lastnosti snovi. Preproste snovi. Tekoče snovi. Zapletene snovi. Voda. Kisik Danes začnemo preučevati eno najstarejših najpomembnejših znanosti, kemijo. „Razvrstitev snovi“ - Razvrstitev snovi. Kisla. Hidroksid ni: Izločite snov, ki je za razvrstitev nepotrebna. Maseni deleži elementov v spojini so enaki: kalij - 43,1%, klor - 39,2%, kisik - 17,7%. Preproste snovi so kovine. Porazdelite snovi. Srebrna Kovine in nekovine. Ogljik Naloga C2 USE v kemiji je opis kemičnega eksperimenta, v skladu s katerim bo potrebno sestaviti 4 reakcijske enačbe. Po statističnih podatkih je to ena najtežjih nalog, zelo majhen odstotek predaje se spopada z njo. Sledijo priporočila za reševanje naloge C2. Prvič, za pravilno reševanje naloge C2 Enotnega državnega izpita iz kemije si moramo pravilno predstavljati dejanja, ki se jim podvržejo snovi (filtracija, izhlapevanje, kalcinacija, kalcinacija, sintranje, fuzija). Razumeti je treba, kje se s snovjo pojavlja fizični pojav in kje kemična reakcija. Spodaj so opisana najpogosteje uporabljena dejanja s snovmi. Filtriranje - metoda za ločevanje nehomogenih zmesi s filtri - poroznimi materiali, ki tekočini ali plinu omogočajo, da prehajajo skozi, vendar zadržujejo trdne snovi. Pri ločevanju zmesi, ki vsebujejo tekočo fazo, skozi filter ostane trdna snov filtrat . Izhlapevanje - postopek koncentracije raztopin z izhlapevanjem topila. Včasih poteka izparevanje, dokler ne dobimo nasičenih raztopin, da se iz njih dalje kristalizira trdna snov v obliki kristalnega hidrata ali dokler topilo popolnoma ne izhlapi, da dobimo raztopljeno snov v čisti obliki. Kalcinacija -
segrevanje snovi, da se spremeni njena kemična sestava. Kalcinacija se lahko izvaja v zraku in v atmosferi inertnega plina. Pri kalciniranju na zraku kristalni hidrati izgubijo kristalizacijsko vodo, na primer CuSO 4 ∙ 5H 2 O → CuSO 4 + 5H 2 O Sintranje, fuzija -
to je segrevanje dveh ali več trdnih reagentov, kar vodi v njihovo medsebojno delovanje. Če so reagenti odporni na oksidanti, potem lahko sintranje izvajamo na zraku: Če lahko eden od reaktantov ali produkta reakcije oksidira z zračnimi komponentami, postopek izvedemo v inertni atmosferi, na primer: Cu + CuO → Cu 2 O Snovi, ki niso občutljive na delovanje sestavnih delov zraka, ko se kalcinirajo, oksidirajo, reagirajo s sestavinami zraka: Izstrelitev - postopek toplotne obdelave, ki vodi do zgorevanja snovi. Drugič, poznavanje značilnih znakov snovi (barva, vonj, agregacija) vam bo služilo kot namig ali preverjalo pravilnost izvedenih dejanj. Spodaj so najbolj značilni znaki plinov, raztopin, trdnih snovi. Znaki plinov:Slikano: Cl 2 - rumeno-zelena; NE 2 - rjava; O 3 - modra (vsi imajo vonjave). Vsi so strupeni, raztopijo se v vodi, Cl 2 in NE 2 reagirati z njo. Brezbarven, brez vonja: H 2, N 2, O 2, CO 2, CO (strup), NO (strup), inertni plini. Vsi so slabo topni v vodi. Brezbarven z vonjem: HF, HCl, HBr, HI, SO 2 (ostre vonjave), NH 3 (tekoči amoniak) - dobro topen v vodi in strupen, PH 3 (česen), H 2 S (gnila jajca) - rahlo topen v vodi, strupen. Barvne rešitve:Rumena: Kromati, na primer K 2 CrO 4, raztopine železovih (III) soli, na primer FeCl3. Oranžna: Bromova voda, alkohol in alkoholno-vodne raztopine joda (odvisno od koncentracije rumena prej rjava), dikromati, na primer K 2 Cr 2 O 7 Zeleni: Kromovi (III) hidrokso kompleksi, na primer K3, nikljeve (II) soli, na primer NiSO 4, mangani, na primer K 2 MnO 4 Modra: Bakrene (II) soli, npr. CuSO4 Od roza do vijolične: Permanganati, npr. KMnO 4 Od zelene do modre: Kromove (III) soli, npr. CrC13 Pobarvane padavine:Rumena: AgBr, AgI, Ag 3 PO 4, BaCrO 4, PbI 2, CdS Rjava: Fe (OH) 3, MnO2 Črna, črna in rjava: Sulfidi bakra, srebra, železa, svinca Modra: Cu (OH) 2, KFe Zeleni: Cr (OH) 3 - sivo-zelena, Fe (OH) 2 - umazano zelena, v zraku postane rjava Druge obarvane snovi:Rumena : žveplo, zlato, kromati Oranžna: bakreni (I) oksid - Cu 2 O, dikromati Rdeče: brom (tekoč), baker (amorfni), rdeči fosfor, Fe 2 O 3, CrO 3 Črna: CuO, FeO, CrO Siva s kovinskim sijajem: Grafit, kristalni silicij, kristalni jod (pri sublimaciji - vijolična pari), večina kovin. Zeleni: Cr 2 O 3, malahit (CuOH) 2 CO 3, Mn 2 O 7 (tekoč) Tretjič, pri reševanju nalog C2 iz kemije za večjo jasnost lahko priporočamo izdelavo shem preoblikovanja ali zaporedja pridobljenih snovi. In končno, za rešitev takšnih težav je treba jasno poznati lastnosti kovin, nekovin in njihovih spojin: oksidov, hidroksidov, soli. Ponoviti je treba lastnosti dušikove in žveplove kisline, kalijevega permanganata in dikromata, redoks lastnosti različnih spojin, elektrolizo raztopin in talin različnih snovi, reakcije razgradnje spojin različnih razredov, amfoternost, hidrolizo soli.
Za popolno odstranitev hlapnih snovi, ki nastanejo pri toplotnem razkroju, se uporablja kalcinacija, ki jo lahko izvedemo s plamenom plinskega gorilnika v muhastih ali lončenih pečeh. Za žganje v plamenu gorilnika se snov položi v kovinski ali porcelanski lonček. Nato jo vstavimo v porcelanski trikotnik, tako da vstopi v trikotnik na 2/3 njegove višine. Na obroču za stativ je postavljen porcelanski trikotnik. Odstranjevanje se izvede v dimni kaputi. Olupne peči se uporabljajo za žganje snovi pri povišanih temperaturah (do 1600 ° C). Reagenti se ne smejo razliti v delovni prostor peči. Vroči lončki se odstranijo iz muhečne peči z dolgimi krilnimi lonci. FiltriranjeTo je postopek premikanja skozi porozni septum tekočine ali plina, ki ga spremlja odlaganje trdnih snovi, suspendiranih v njih, na poroznem septumu. delci. Učinkovitost postopka filtriranja se oceni s hitrostjo in popolnostjo ločevanja trdnih delcev od tekočine ali plina. Nanjo vplivajo: viskoznost (tekočine z nizko viskoznostjo lažje filtriramo), temperatura (višja kot je temperatura, lažje se filtrira raztopina, ker se viskoznost tekočine s segrevanjem zmanjšuje), tlak (večja je razlika tlaka na obeh straneh filtra, večja je hitrost filtriranje), velikost in narava delcev trdne snovi (večja kot je velikost delcev v primerjavi z velikostjo filtra, hitrejše in lažje je filtriranje). Kot filtrirne materiale se uporabljajo različne organske in anorganske snovi. Ne smemo pozabiti, da za filtriranje ni mogoče uporabiti materialov, ki kakorkoli vplivajo na filtrirano tekočino. Na primer, alkalij, zlasti koncentriranih, ni mogoče filtrirati skozi filter iz stiskanega stekla in drugih materialov, ki vsebujejo silicijev dioksid, saj se SiO 2 raztopi v alkalijah. Materiali za filtriranje so lahko: vlaknasti (bombažna volna, volna, različne tkanine, sintetična vlakna), zrnati (kremenčev pesek), porozni (papir, keramika). Izbira filtrirnega materiala je odvisna od zahtev po čistosti raztopine, pa tudi od njegovih lastnosti. Filtriranje se lahko izvaja na različne načine: v običajnih pogojih, pri segrevanju, pod vakuumom. V normalnih pogojih se za filtriranje uporabljajo stekleni lijaki. Znotraj lijaka je nameščen nekakšen filtrirni material, na primer bombažna volna, filtrirni papir. Enostavni ali nagubani filtri so narejeni iz filtrirnega papirja. Za pripravo preprostega filtra vzemite list filtrirnega papirja kvadratne oblike. Najprej podvoji, nato spet, kot je prikazano na sliki a:
Izkazalo se je, da se zmanjša za 4-krat več kot kvadrat. Vogal zloženega kvadrata je rezan s škarjami v loku. S prstom ločite eno plast papirja od ostalih treh in jo razširite. Za pripravo zloženega filtra naredijo najprej enako kot pri izdelavi preprostega, nato ga prepognemo na polovico in vsako polovico večkrat upognemo v eno in drugo smer kot harmonika (slika B). Zgornji rob filtra ne sme doseči roba lijaka za 5 mm. Filter, pravilno postavljen v lijak, je navlažen s filtrirano tekočino ali destilirano vodo.
Tekočina se vlije na stekleno palico in jo pritisne ob steno lijaka. Če želite vročo raztopino filtrirati, uporabite poseben lijak za vročo filtracijo z električnim ali vodnim ogrevanjem. Filtracija pod znižanim tlakom (pod vakuumom) omogoča popolnejše ločevanje trdnih snovi od Kalcinacija suhega ostanka vam omogoča, da določite približno razmerje mineralnih in organskih delov onesnaženja. Razmerje mase pepela in teže suhega ostanka se imenuje vsebnost pepela v suhem ostanku in je izražena v odstotkih. [...] Kalcinacija je kurjenje odpadkov, ki se izvaja z namenom zmanjšati količino in maso reaktivnih komponent. Vendar pa med kalcinacijo nastajajo odpadki (pepel in žlindra, dimni plini, leteči pepel in odpadne vode, ki nastanejo pri predelavi pepela in čiščenja dimnih plinov), ki škodujejo okolju. Zato kalcinacija ni najboljši način za odstranjevanje trdnih organskih odpadkov. […] Kalcinacija je tretja, zelo pomembna operacija pri proizvodnji TU2, saj izdelek med kalcinacijo pridobi potrebne pigmentne lastnosti. Med kalcinacijo se zaradi razgradnje bazičnih titanovih sulfatov voda in E03 odstranijo iz metatitanske kisline. Praksa je pokazala, da nekatere izdelke z nizko vsebnostjo BOS težje izločajo kot TU304, v prisotnosti nečistoč, kot je K2504, pa se odstranjevanje BOS olajša in začne že pri 480 °. [...] Pri kalciniranju naboja je treba dosledno upoštevati temperaturni režim postopka, saj ko se temperatura dvigne na 750-800 °, rjave in celo črne, se na površini taline začnejo pojavljati tako imenovane "rjave lise". Z nadaljnjim zvišanjem temperature se te pege razširijo po celotni površini, nato pa po celotni masi taline. Če v mešanici primanjkuje borove kisline ali če je lepa zmešana s krompejkom na plaži, se lahko tvorijo tudi rjave pike, ki so sestavljene iz neraztopljenega krompeksa, ki so zlahka topne v vodi in niso enake "rjavim madežem", ki so posledica razpada taline. Ob koncu kalcinacije se talina iz peči odvaja na železne pekače, na katerih se ohladi. Zmes se naloži v peč v zelo majhnih količinah zaradi močne ekspanzije med kalcinacijo. Tako lahko na primer v električni peči s površino 0,5 m2 napolnimo le 10-15 kg naboja, iz katerega dobimo 1,5-2,5 kg končnega pigmenta. Kalcinacija naboja smaragdno zelene traja 1,5-2 ure. […] Pri kalciniranju praznega membranskega filtra dobimo tako malo pepela, da ga je pri izračunu mogoče zanemariti. [...] Temperatura kalcinacije 500-600 °. Barva pigmenta se nastavi pri tej temperaturi po 20–30 minutah, v praksi pa trajanje kalcinacije doseže g do 2 uri, saj pri krajšem trajanju ostanejo v pigmentu nepoškodovane nečistoče. […] Ostanki po kalcinaciji. Za določitev ostankov po kalcinaciji grobih nečistoč ("kalcinirane grobe nečistoče") uporabimo suspendirani membranski filter s kleščami ali pinceto in ga zelo previdno sežigamo nad porcelanskim lončkom, ki smo ga predhodno kalcizirali in stehtali. [...] Ostanki po kalcinaciji. Kalciranje porcelanastega ali kremenčevega lončka s filtriranimi grobimi nečistočami je priporočljivo v električni peči za muffle pri 600 ° C 10-15 minut. Vsebnost ostankov po kalcinaciji se izračuna po formuli iz točke "A" (glej stran 20). [...] Ostanke po kalcinaciji določimo, kot je opisano v oddelku "A" (glej stran 20). [...] Pogoji nanašanja in kalcinacije močno vplivajo na pigmentne lastnosti kadmijevega sulfida, to je na njegovo barvo, moč skrivanja, intenzivnost, stabilnost itd. [...] Trdne snovi in \u200b\u200bizgube zaradi kalcinacije. V praksi obdelavo vode pod suhim ostankom razumemo kot skupno količino anorganskih in organskih spojin v raztopljenem in koloidnem raztopljenem stanju. Suhi ostanek določimo z izhlapevanjem predhodno filtriranega vzorca, čemur sledi sušenje pri 10 ° C. Izgube pri vžigu določajo vsebnost trdnih snovi v organskih snoveh. Ostanki po kalcinaciji označujejo slanost vode. [...] Bistvo postopka je reducirano na žarjenje apatita pri 1400-1450 ° (z dodatkom 2-8% kremena) ali karatau fosforita (z dodatkom apna) v prisotnosti vodne pare. V teh pogojih se kristalna rešetka apatita uniči in fluor se odstrani za 90%. Dobimo različne sestave fosfatov, topnih v šibkih kislinah. Pri predelavi apatita gnojilo vsebuje 30-32% P205, medtem ko kalcinira fosforit - 20-22%; 70-92% teh fosfatov je topnih v 2% citronski kislini. Ugotovljeno je bilo, da v enakih odmerkih superfosfata P2Oi in defluoriniranega fosfata z glavno uporabo dajeta blizu učinek. Defluorinirani fosfat se uporablja tudi za mineralno prehrano živali. [...] Vsebnost pepela se določi s zgorevanjem in žganjem filtra z usedlinami po določitvi koncentracije aktivnega blata. Razlika med težo suhe snovi aktivnega blata in težo pepela označuje organski del aktivnega blata - izgubo prave kalcinacije. [...] Zmes 60% COO in 40% ZnO po skoraj vse kalcinaciji sestoji iz ZnCo204. Z nižjo vsebnostjo kobalta nastajajo temno zeleni izdelki, ki so mešanica ZnCo204 s cinkovim oksidom. [...] Razlikujemo med celotnim suhim ostankom in ostankom po kalcinaciji. Izraz "skupni suhi ostanek" pomeni količino snovi, ki ostane po izhlapevanju vzorca odpadne vode in sušenja do konstantne teže. Količina snovi, dobljene po žganju suhega ostanka, se imenuje "ostanek po kalcinaciji". Z zmanjšanjem mase suhih ostankov po kalcinaciji lahko presodimo vsebnost organskih snovi v odpadni vodi. Samica psica je določena v skladu s PN-59 / Z-04519. [...] Mehanizem nastanka rdečega kadmija med kalcinacijo mešanice žvepla, selena in kadmijeve soli je verjetno naslednji: pri 250-300 ° C kadmij ali oksalna kislina disociirata v ogljikov dioksid in kadmijev oksid. Slednji se v tem primeru oblikuje v zelo aktivnem, reaktivnem stanju in takoj poseže z žveplom in selenom, tvori rdečo maso z močnim rjavim odtenkom. Ta masa vsebuje določeno količino žvepla in selena kadmija v obliki njihove mešanice (Сс1 4-С [...] Češnje se imenujejo proizvodi, pridobljeni s kalcinacijo brez dostopa do zraka različnih organskih snovi živalskega in rastlinskega izvora. [...] Vsebnost hlapnih trdnih delcev se določi s kalciniranjem ostanka pri temperaturi 550 ° C v električni peči. Preostali del pitne in naravne vode ter blato se kalcinira 1 uro, za ostanke vzorcev odpadne vode pa je potrebna le 20-minutna kalcinacija. Masna izguba med kalcinacijo je izražena v mg hlapnih snovi na 1 liter, ostanek po kalcinaciji pa imenujemo nehlapni trdni delci. Izhlapevalno skodelico, uporabljeno v analizi za vsebnost hlapnih trdnih delcev, in filtrirni disk iz steklenih vlaken je treba predhodno obdelati z žganjem v peči za muffle, da se določi natančna začetna neto teža. Hlapne delce v odpadni vodi pogosto razlagajo kot merilo organske snovi. Vendar pa to ni povsem natančno, saj zaradi zgorevanja številnih organskih snovi nastane pepel in med kalcinacijo izhlapi veliko anorganskih soli. [...] Tehnološki postopek za proizvodnjo rdečega železovega oksida s žganjem železovega oksida ali hidrata železovega oksida obsega naslednje postopke: priprava železovega oksida ali hidrata železovega oksida, pranje, filtriranje in sušenje dobljenega hidrata ter na koncu žganje suhega ali mokrega kolača pri 600-700 °. [...] Notranji premer retorta je 2,7 m, uporabna višina (območje sušenja, žganja in hlajenja premoga) je 15,1 m. Skupna višina retorta je 26 m. [...] Skupna suha trdna snov je tudi mineralnega izvora, izguba pri vžigu je 8%. Koncentracija kloridov in sulfatov je sorazmerno nizka, vendar je koncentracija soli silicijeve kisline zelo pomembna (-300 mg! L) zaradi uporabe tekočega stekla kot flotacijskega reagenta. Cijanidi, baker in arzen vsebujejo majhne količine. Organski reagenti, ki se uporabljajo v flotaciji, so zelo občutno onesnaževanje: naftni proizvodi, terpineol, ksantat (ali ditiofosfat), ki povečajo oksidacijo vode na več kot 100 mg / l O. [...] Budnikova in Gulinova, da bi ugotovili odvisnost aktivnosti kaolina od temperature njegove kalcinacije, smo izmerili toploto interakcije s kalcijevim hidratom. Ugotovili so, da je mejna temperatura kalcinacije, nad katero pade aktivnost kaolina, temperatura okoli 800 °. Praksa proizvodnje ultramarina tudi potrjuje, da je kaolin, kalciniran pri temperaturi nad 800 °, težje vstopiti v ultramarinsko reakcijo. […] Postopek izdelave rumenega kadmija po tej metodi je sestavljen iz naslednjih postopkov: priprava in kalcinacija mešanice, pranje, sušenje, mletje in presejanje pigmenta. [...] Vode so motne, rumenkaste barve, s pH od 6,7 do 9,5. Izguba grobih nečistoč in skupnega suhega ostanka med kalcinacijo je zanemarljiva, kar kaže na prevlado mineralnih snovi (rudnih delcev) v njihovi sestavi. Osnova raztopljenih mineralnih soli celotnega odtoka so sulfati. S prehodom odpadne vode skozi jalovino se količina grobih nečistoč močno zmanjša. [...] Najstarejša metoda za določitev skupne vsebnosti organskih nečistoč je določitev izgube pri vžigu. S pečenjem na 110 ° C ostanka, dobljenega po izhlapevanju vzorca, lahko s temnim barvanjem ostanka in karbonizacijo le-tega zaznamo številne organske snovi (ogljikove hidrate, beljakovinske spojine). Izguba zaradi vžiga kaže tudi na prisotnost nekaterih anorganskih snovi. [...] Kadmijev sulfid, ki ga tvorijo oborine s hiposulfitom, ima srednje rumeno barvo z zelo živahnim in svetlim odtenkom. Ko je pigment kalciniran na 500 °, se njegova barva ne spremeni, pri 550-600 ° pa postane nekoliko svetlejša. [...] Oborina se kalcinira v peči za muffle pri temperaturi 700-750 ° C, pri temperaturi nad 800 °, oborina razpade na BaO in o03. Trajanje prve kalcinacije je 30 minut, druge - 20 minut [...] Od vseh sorbentov je najboljši aktivni glinica. Izdelana je iz glinene glinice. Ta reagent se aktivira z dvojno kalcinacijo pri 800 ° C z vmesnim hlajenjem in močenjem s 15% raztopino sode. Višina sloja sorbenta v filtru mora biti približno 2 m. Njegova delovna izmenjalna zmogljivost (po Vodgeo) je 1,25 kg fluora na 1 m3 sorbenta. [...] Ko je bilo blato kalcinirano pri temperaturi kurjenja ploščic, to je pri 900 ° C, smo našli difrakcijske maksimume, ki jih lahko pripišemo Fe304. Izrabljeno aktivno blato vsebuje hidrokside železa in niklja, potem ko so se pojavili odsevi kalcinacije, ki jih je mogoče prepoznati kot M1re204 - nikelj-špeneli. [...] Po sušenju oborjene suspenzije pri temperaturi 105 ° C in tehtanju določimo vsebnost (v mg / l) usedlin. Razmerje mase preostalega pepela po žganju suhega blata pri temperaturi 600 ° C in skupne mase absolutno suhega blata (v%) imenujemo vsebnost pepela v slednjem. Izguba izgorelih snovi med kalcinacijo določa količino snovi brez pepela. [...] Od opisanih metod za proizvodnjo rumenega kadmija so najbolj praktične uporabe: interakcija kadmijevega karbonata z natrijevim sulfidom, kalcinacija kadmijevega karbonata z žveplom in interakcija kadmijeve soli s hiposulfitom. Ko delate na teh metodah, lahko dobite rumen kadmij v vseh odtenkih - od limone do oranžne. Oranžni kadmij nastane tudi s kalciniranjem kadmijevega karbonata z mešanico žvepla in selena. Ta metoda je opisana spodaj. Obarjanje rumenega kadmija se izvaja v lesenih, porcelanskih ali emajliranih rezervoarjih, kalcinacija v muškatnih ali vrtljivih pečeh. [...] Nekatere od teh pigmentiranih v vodi topnih soli lahko celo povzročijo pospešeno korozijo. Na primer, Mars, ki ga dobimo s kalciniranjem železovega sulfata, lahko vsebuje manjše količine nekaljenega sulfata, ki je zelo močno jedko sredstvo. Zato je pred uporabo potrebno preveriti kemijsko sestavo Marsa in zlasti vsebnost železovega sulfata v njih, čeprav takšna analiza ne omogoča presojanja drugih lastnosti tega pigmenta, na primer skrivnosti itd. Kemična sestava pigmentov je pomembna, vendar ne samo presoditi o kakovosti pigmentov ter trdnosti in trajnosti filmov, pripravljenih iz njih, pa tudi zato, ker nekatere snovi, ki sestavljajo pigmente, škodljivo vplivajo na človeško telo. [...] Uporaba ekstrakcije za regeneracijo oljnega blata je pokazala, da se vsebnost vlage v dobljenem blatu giblje med 65-75%. Pri nevtralizaciji tega blata s kalcinacijo v bobničnih pečeh so potrebni toplotni stroški, ki so skoraj enaki toploti, ki jo lahko dobimo iz naftnega proizvoda, ki se pridobiva iz naftnega blata. Zato je odstranjevanje naftnih derivatov iz naftnega blata v tem primeru nedonosno. [...] Tako se lahko pri proizvodnji kadmijevega sulfida spremeni zelo veliko dejavnikov, in sicer: začetne soli kadmija in sulfida, pogoji nalaganja in kalcinacije itd., Zaradi česar lahko pride do zelo velikega števila metod za pridobivanje kadmijevega sulfida določene barve in lastnosti. In res, v različnih obdobjih je bilo predlagano veliko metod za proizvodnjo kadmijevega sulfida, primernega za uporabo kot pigment. […] Potek določitve. V isto epruveto, ki je bila uporabljena pri izdelavi tehtnice, nalijemo 10 ml vode, odvzete neposredno ali po izhlapevanju, kalcinacijo suhega ostanka, raztapljanje v vodi, nevtralizacijo s fenolftaleinom z dušikovo kislino in razredčitev do določene količine (glej prejšnjo metodo ) Dodamo 1,00 ml raztopine živosrebrovega nitrata (P) in 2 kapljici raztopine difenilkarbazida. Po 10-15 minutah dobljeno barvo primerjamo z barvo raztopin lestvice, pri čemer upoštevamo raztopine od zgoraj. [...] Prvo poročilo o železnem azuru je bilo izdelano leta 1710, vendar ni vsebovalo podatkov o načinu njegove izdelave. Metoda pridobivanja železove azure je bila objavljena šele leta 1724 in je bila sestavljena iz kalcina goveje krvi s kalijem in oboritve zakisljenega vodnega ekstrakta te taline z železov sulfat in alum. Kasneje (leta 1735) so ugotovili, da lahko namesto krvi uporabimo druge snovi živalskega izvora - rog, kremplje, lase, kožo itd. [...] Kemično onesnaženje je določeno s kemijsko analizo odpadne vode, določanjem temperature, barve, vonja, preglednosti, usedlin po prostornini in masi, suspendirane trdne snovi po teži in izgube pri vžigu, trdni ostanki pri vžigu, oksidativnost, kemična potreba po kisiku (COD), biokemična potreba v kisiku (BPK), dušiku običajnih in amonijevih soli, pH reakciji, kislosti in alkalnosti, kloridi, fosfati, sulfati, koncentracija kislih soli, fenoli, cianidi, rodonidi, soli težkih kovin in druge kemične uporabe si. [...] Kot je razvidno iz predstavljenih podatkov, so glavno onesnaževanje odpadne vode iz obratov za obogatitev z molibdenom-volfram grobe nečistoče mineralnega izvora, saj izguba pri vžigu znaša le 4,5% celotne količine. Pri prehodu skozi reke se koncentracija nečistoč v skupnem odtoku zmanjša le za 70%, to je, da je voda slabo prečiščena, prosojnost pa se poveča le na 2,1 cm. [...] Pri mehčanju vode s padavinami dobimo 200 ton blata s specifično maso 1,5, pri čemer je 15% (teže) blata sestavljeno iz trdnih delcev, ki so soli kalcija in magnezija. Ker kalcijeve soli med kalcinacijo tvorijo kalcijev oksid, ki ga lahko uporabimo v procesu mehčanja vode, prej stisnjeno blato pošljemo v peč. V postopku stiskanja (centrifugiranja) se 70% trdnega materiala blata loči, stisnjeno blato - centrat - vsebuje 65% (po teži) trdnega materiala. [...] Študije so pokazale, da so naftni koksi precej reaktivni glede atmosferskega kisika tudi pri zmernih reakcijskih temperaturah (520 ° C) do temperatur predhodne kalcinacije 800-1200 ° C. Pri temperaturah oksidacije nad 540 ° C (glej tabelo I) pride do vžiga kalciniranega koksa in postopek preide iz območja kinetične reakcije v območje difuzije, kjer se kurjenje koksa določi z dovajanjem kisika. Iz tega sledi, da je treba kuriti koksni prah pri temperaturah nad 550 + 600 ° C. [...] Ena izmed možnih rešitev problema je kemijsko-metalurška metoda, ki je bila razvita pri nas, po kateri kot metalurški proizvod dobimo dva izdelka natrijevega monokromata in ferokroma. Natrijev monokromat dobimo s kalciniranjem mešanice, ki je sestavljena iz kromove rude, soda pepela in trdnega ostanka (brez dolomit). Po kalciniranju se sinter izluži, zaradi česar nastane raztopina natrijevega monokromata in trden ostanek v obliki zrnc, ki vsebujejo 30-35% kromovega oksida. [...] Barva kadmijevega sulfida, pridobljena s to metodo, je zlato rumena. Žveplov kadmij v drugih odtenkih, in sicer; limona, svetlo rumena in oranžna - te metode ni mogoče dobiti, saj sprememba razmerja med reagenti in pogoji kalcinacije ne vpliva na barvo kadmijevega sulfida. [...] Odpadne vode z gravitacijskimi koncentracijskimi napravami, v tehnološkem postopku katerih flotacijski reagenti niso uporabljeni, so onesnažene z grobimi nečistočami (flotacijski jalovi, mulj, peski), sestavljeni iz odpadnih kamnin, ki spremljajo plavajoče minerale. Izguba pri vžigu grobih nečistoč gravitacijskih tovarn predstavlja 2,5% njihove skupne količine. [...] V šaržnem postopku se toplota grelnega medija slabo porabi v drugi polovici zavoja retorta. Temu se lahko izognemo tako, da uredimo navpično neprekinjeno retorto, v kateri se sveža drva dovajajo na vrh retorta in se, ko se pod vplivom lastne teže premika od vrha do dna, najdejo s plini s kombiniranim ciklom vedno višje temperature. V tem primeru surovine postopoma prehajajo skozi območja sušenja, suhe destilacije, žganja in hlajenja. |
Priljubljeno:
Novo
- Zanimivi in \u200b\u200buporabni domači izdelki
- Risba domačega odpadnega nakovanja
- Kako narediti otroški mehanski bager iz regalov
- Žar v obliki parne lokomotive naredi sam
- Naredite srednjeveški grad iz kartona z lastnimi rokami
- Plinski gorilniki z nizkim pritiskom
- Ročaj z dvema lesenima ročajema za nož
- Naredite samski motorni pes, diagram in risbe Dimenzije risbe psov motornih koles
- Kako vstaviti drsnik v zadrgo
- Naredite domačo prikolico za traktor, video











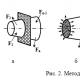
 Pri filtriranju je lijak pritrjen na obroču za stativ. Konica lijaka naj se dotika stene posode za izcedno tekočino.
Pri filtriranju je lijak pritrjen na obroču za stativ. Konica lijaka naj se dotika stene posode za izcedno tekočino. tekočine in povečajo hitrost postopka. V ta namen je sestavljena naprava, ki sestoji iz filtrirne naprave - Buchnerjev lijak (1), povezan z bučko Bunsen (2), Buchnerjeva bučka je s črpalko povezana z gumijasto cevjo. Velikost Buchnerjevega lijaka mora ustrezati masi usedline, ne pa tekočine. Na mrežno dno Buchnerjevega lijaka sta dva kroga filtrirnega papirja, navlažena z destilirano vodo, pritrjena na črpalko, zaradi česar se filter tesno prilega na mreži lijaka. Začnite postopek filtriranja. Najprej večino tekočine vlijemo na filter, nato preostalo tekočino stresemo s usedlino in zmes vlijemo v lijak. Pri filtriranju usedlina ne sme prepolniti lijaka in filtrat v bučki Bunsen ne bi smel doseči postopka, ki je bučko povezoval z varnostno bučko. Na koncu filtracije se črpalka najprej izklopi, nato se lijak odstrani iz bučke, oborina pa se izbere na listu filtrirnega papirja.
tekočine in povečajo hitrost postopka. V ta namen je sestavljena naprava, ki sestoji iz filtrirne naprave - Buchnerjev lijak (1), povezan z bučko Bunsen (2), Buchnerjeva bučka je s črpalko povezana z gumijasto cevjo. Velikost Buchnerjevega lijaka mora ustrezati masi usedline, ne pa tekočine. Na mrežno dno Buchnerjevega lijaka sta dva kroga filtrirnega papirja, navlažena z destilirano vodo, pritrjena na črpalko, zaradi česar se filter tesno prilega na mreži lijaka. Začnite postopek filtriranja. Najprej večino tekočine vlijemo na filter, nato preostalo tekočino stresemo s usedlino in zmes vlijemo v lijak. Pri filtriranju usedlina ne sme prepolniti lijaka in filtrat v bučki Bunsen ne bi smel doseči postopka, ki je bučko povezoval z varnostno bučko. Na koncu filtracije se črpalka najprej izklopi, nato se lijak odstrani iz bučke, oborina pa se izbere na listu filtrirnega papirja.