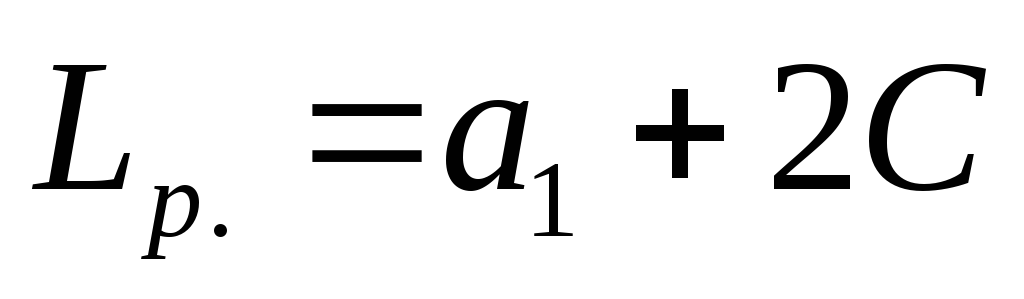സൈറ്റ് വിഭാഗങ്ങൾ
എഡിറ്റർ\u200cമാരുടെ ചോയ്\u200cസ്:
- ഡ്രൈവ്\u200cവാളിന് കീഴിലുള്ള ഒരു പ്രൊഫൈൽ എങ്ങനെ ഉറപ്പിക്കാം, ഏത് നഖങ്ങളുപയോഗിച്ച് സസ്പെൻഡ് ചെയ്ത സീലിംഗിന്റെ നേരിട്ടുള്ള ഇൻസ്റ്റാളേഷൻ
- ഒരു യന്ത്ര ഉപകരണത്തിന്റെ വിലയിരുത്തലിനെക്കുറിച്ചുള്ള ഒരു റിപ്പോർട്ടിന്റെ ഉദാഹരണം
- ഒരു സ്വകാര്യ വീടിനെ കേന്ദ്ര മലിനജല ശൃംഖലയുമായി എങ്ങനെ ബന്ധിപ്പിക്കാം സ്വകാര്യ മലിനജലം എന്ത് രേഖകളാണ് വേണ്ടത്
- കെട്ടിട ഘടനകളിലേക്ക് വിവിധ തരം പൈപ്പ്ലൈനുകൾ അറ്റാച്ചുചെയ്യുന്നു
- കെട്ടിട ഘടനകളിലേക്ക് വിവിധ തരം പൈപ്പ്ലൈനുകൾ അറ്റാച്ചുചെയ്യുന്നു
- ഒരു അപ്പാർട്ട്മെന്റ് കെട്ടിടത്തിന്റെ പ്രവേശന കവാടത്തിന്റെ അറ്റകുറ്റപ്പണി
- കോൺക്രീറ്റിംഗ് അയവുള്ള ഗുണകം
- വാൾപേപ്പർ പെയിന്റിംഗ്: ഒരു ചതുരശ്ര മീറ്ററിന് ജോലിയുടെ ചെലവ്
- കേബിൾ ക്ലിപ്പ് - സ്റ്റെയിൻലെസ് സ്റ്റീൽ മൂലകങ്ങളുടെ പ്രധാന തരങ്ങൾ, ആപ്ലിക്കേഷനും പ്രോസസ്സിംഗും (75 ഫോട്ടോകൾ) കേബിൾ ടെൻഷൻ
- കേബിൾ ക്ലിപ്പ് - സ്റ്റെയിൻലെസ് സ്റ്റീൽ മൂലകങ്ങളുടെ പ്രധാന തരങ്ങൾ, പ്രയോഗവും പ്രോസസ്സിംഗും (75 ഫോട്ടോകൾ) ധ്രുവത്തിലേക്ക് കേബിൾ ഉറപ്പിക്കുന്നതിനുള്ള രീതികൾ
പരസ്യംചെയ്യൽ
| പ്രകൃതിയിലും മനുഷ്യജീവിതത്തിലും സൾഫർ ഓക്സൈഡ്. സൾഫർ ഓക്സൈഡ് (IV), സൾഫ്യൂറിക് ആസിഡ് |
|
മിക്ക സൾഫർ (IV) ഓക്സൈഡും സൾഫർ ഡയോക്സൈഡ് ഉത്പാദിപ്പിക്കാൻ ഉപയോഗിക്കുന്നു. സൾഫർ ആസിഡിന്റെ വിവിധ ലവണങ്ങൾ ലഭിക്കുന്നതിന് സൾഫർ ഓക്സൈഡ് (IV) ഉപയോഗിക്കുന്നു. ബേസ്, ബേസിക് ഓക്സൈഡുകൾ എന്നിവയുമായുള്ള പ്രതിപ്രവർത്തനങ്ങളിൽ സൾഫ്യൂറിക് ആസിഡ് അസിഡിക് ഗുണങ്ങൾ കാണിക്കുന്നു. സൾഫ്യൂറിക് ആസിഡ് ഡൈബാസിക് ആയതിനാൽ, ഇത് രണ്ട് വരികളുള്ള ലവണങ്ങൾ ഉണ്ടാക്കുന്നു: ഇടത്തരം - സൾഫേറ്റുകൾ, ഉദാഹരണത്തിന് Na2SO4, ആസിഡ് - ഹൈഡ്രോസൾഫേറ്റുകൾ, ഉദാഹരണത്തിന് NaHSO4. ഇത് എത്തനോൾ, സൾഫ്യൂറിക് ആസിഡ് എന്നിവയിലും ലയിക്കുന്നു. ശക്തമായ റിഡക്ഷൻ ഏജന്റുകളുടെ സാന്നിധ്യത്തിൽ, ഓക്സിഡൈസിംഗ് ഗുണങ്ങൾ പ്രകടിപ്പിക്കാൻ SO2 ന് കഴിയും. രാസ സസ്യങ്ങളുടെ പുക ജ്വാലകളിൽ നിന്നുള്ള സൾഫ്യൂറിക് ആസിഡ് എയറോസോൾ താഴ്ന്ന മേഘങ്ങളിലും ഉയർന്ന ആർദ്രതയിലും കാണപ്പെടുന്നു.
വടക്കൻ അർദ്ധഗോളത്തിൽ സൾഫർ വാതകം ഏറ്റവും ഉയർന്ന സാന്ദ്രതയിലെത്തുന്നു, പ്രത്യേകിച്ചും യുഎസ്എ, യൂറോപ്പ്, ചൈന, റഷ്യയുടെ യൂറോപ്യൻ ഭാഗം, ഉക്രെയ്ൻ എന്നിവയുടെ പ്രദേശങ്ങളിൽ. സൾഫ്യൂറിക് ആസിഡിനെയും ലയിക്കുന്ന സൾഫേറ്റുകളെയും തിരിച്ചറിയാൻ BaSO4 (ആസിഡുകളിൽ ലയിക്കാത്ത) ന്റെ ഒരു വെളുത്ത പ്രിസിപൈറ്റിന്റെ രൂപീകരണം ഉപയോഗിക്കുന്നു. സൾഫ്യൂറിക് ആസിഡ് ലായനിയിൽ മാത്രമേ നിലനിൽക്കൂ. സൾഫർ ട്രയോക്സൈഡ് അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടമാക്കുന്നു. രാസ വ്യവസായത്തിന്റെ ഏറ്റവും പ്രധാനപ്പെട്ട ഉൽ\u200cപ്പന്നമായ സൾഫ്യൂറിക് ആസിഡ് ലഭിക്കുന്നതിന് ഈ പ്രതികരണം ഉപയോഗിക്കുന്നു. സൾഫർ ട്രയോക്സൈഡിലെ സൾഫറിന് ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥ ഉള്ളതിനാൽ സൾഫർ ഓക്സൈഡ് (VI) ഓക്സിഡേറ്റീവ് ഗുണങ്ങൾ പ്രദർശിപ്പിക്കുന്നു. ചോദ്യം: ആസിഡുകളുടെ ഏത് രാസ ഗുണമാണ് നിങ്ങൾക്ക് അറിയാവുന്നത്? ഇത് ഒരു പ്രിസർവേറ്റീവ് (ഫുഡ് സപ്ലിമെന്റ് E220) ആയി ഉപയോഗിക്കുന്നു. ഈ വാതകം സൂക്ഷ്മാണുക്കളെ കൊല്ലുന്നതിനാൽ, അവ പച്ചക്കറി സ്റ്റോറുകളും വെയർഹ ouses സുകളും ഉപയോഗിച്ച് നശിപ്പിക്കപ്പെടുന്നു. നോൺ-ഫെറസ്, ഫെറസ് മെറ്റലർജിയുടെ പൈറോമെറ്റലർജിക്കൽ എന്റർപ്രൈസസും താപവൈദ്യുത നിലയങ്ങളും പ്രതിവർഷം ദശലക്ഷക്കണക്കിന് ടൺ സൾഫ്യൂറിക് അൺഹൈഡ്രൈഡ് അന്തരീക്ഷത്തിലേക്ക് പുറന്തള്ളുന്നു. 4. സൾഫറുമായുള്ള പ്രതിപ്രവർത്തനത്തിലൂടെ സൾഫർ സ്വയം ഓക്സിഡേഷൻ-സ്വയം കുറയ്ക്കുന്നതിനുള്ള പ്രതികരണങ്ങളും സാധ്യമാണ്. അതിനാൽ, SO2, സൾഫ്യൂറസ് ആസിഡ്, അതിന്റെ ലവണങ്ങൾ എന്നിവ ഓക്സിഡൈസ് ചെയ്യുന്നതിനും കുറയ്ക്കുന്നതിനും സഹായിക്കുന്നു. ഹൈഡ്രജൻ സൾഫൈഡ് സൾഫർ, സൾഫൈറ്റുകൾ, തയോസൾഫേറ്റുകൾ, സൾഫ്യൂറിക് ആസിഡ് എന്നിവയുടെ ഉത്പാദനത്തിനും ലബോറട്ടറി പരിശീലനത്തിലും സൾഫൈഡുകളുടെ മഴയ്ക്കായി ഉപയോഗിക്കുന്നു. ഫോസ്ഫോറിക്, ഹൈഡ്രോക്ലോറിക്, ബോറിക്, ഹൈഡ്രോഫ്ലൂറിക്, മറ്റ് ആസിഡുകൾ എന്നിവയുടെ ഉത്പാദനത്തിൽ ഇത് ഉപയോഗിക്കുന്നു. ഇത് ആസിഡ് ഓക്സൈഡുകളുടെ സാധാരണ ഗുണങ്ങൾ പ്രകടിപ്പിക്കുകയും വെള്ളത്തിൽ നന്നായി ലയിക്കുകയും ദുർബലമായ സൾഫ്യൂറിക് ആസിഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു. സൾഫ്യൂറിക് ആസിഡിന്റെ രാസഗുണങ്ങൾ പ്രധാനമായും അതിന്റെ സാന്ദ്രതയെ ആശ്രയിച്ചിരിക്കുന്നു. കീടങ്ങളെയും സസ്യരോഗങ്ങളെയും നിയന്ത്രിക്കാൻ കോപ്പർ സൾഫേറ്റ് CuSO4 5H2O കാർഷിക മേഖലയിൽ ഉപയോഗിക്കുന്നു.
ഓക്സിഡേഷൻ അവസ്ഥ +1 ഉള്ള സൾഫർ സംയുക്തങ്ങൾ3. സൾഫ്യൂറിക് ആസിഡിനെ ഒരു ഇലക്ട്രോലൈറ്റായി ലയിപ്പിക്കുന്ന പ്രതികരണ സമവാക്യങ്ങൾ എഴുതുക. പ്ലാസ്റ്റിക് സൾഫറിന് ഇരുണ്ട നിറമുണ്ട്, റബ്ബർ പോലെ നീട്ടാൻ കഴിയും. ഒരു ഓക്സൈഡ് മറ്റൊന്നിലേക്ക് ഓക്സീകരിക്കപ്പെടുന്ന പ്രക്രിയ പഴയപടിയാക്കുന്നു. രാസപ്രവർത്തനങ്ങളുടെ താപ ഫലങ്ങൾ. രാസ മൂലകങ്ങളുടെ ഓക്സൈഡുകൾ, ഹൈഡ്രോക്സൈഡുകൾ, ഹൈഡ്രജൻ സംയുക്തങ്ങൾ എന്നിവയിൽ കാലാനുസൃതമായ മാറ്റങ്ങൾ. ഹൈഡ്രജന്റെ ഭൗതികവും രാസപരവുമായ ഗുണങ്ങൾ. അസ്ഥിരമായ സൾഫറസ് ആസിഡിന്റെ രൂപവത്കരണത്തോടെ ഇത് വെള്ളത്തിൽ ലയിക്കുന്നു; 20 ° C താപനിലയിൽ 11.5 ഗ്രാം / 100 ഗ്രാം വെള്ളം ലയിക്കുന്നതും താപനില കൂടുന്നതിനനുസരിച്ച് കുറയുന്നു. സൾഫറസ് വാതകത്തിന്റെ ഈ വാസോഡിലേറ്റിംഗ് പ്രഭാവം എടിപി സെൻസിറ്റീവ് കാൽസ്യം ചാനലുകൾ, എൽ-ടൈപ്പ് കാൽസ്യം ചാനലുകൾ ("ഡൈഹൈഡ്രോപിരിഡിൻ") എന്നിവയിലൂടെ മധ്യസ്ഥമാക്കുന്നു. ഭൂമിയുടെ അന്തരീക്ഷത്തിലെ സൾഫർ ഡൈ ഓക്സൈഡ് അന്തരീക്ഷ താപനിലയിലെ വർദ്ധനവിൽ ഹരിതഗൃഹ വാതകങ്ങളുടെ (കാർബൺ ഡൈ ഓക്സൈഡ്, മീഥെയ്ൻ) സ്വാധീനം ഗണ്യമായി കുറയ്ക്കുന്നു. ദാതാവ്-സ്വീകർത്താവ് ബോണ്ടുകളുടെ രൂപീകരണം മൂലം പോളിമറൈസ് ചെയ്യാനുള്ള SO3 തന്മാത്രകളുടെ കഴിവുമായി സൾഫർ ട്രയോക്സൈഡിന്റെ വിവിധ രൂപങ്ങൾ ബന്ധപ്പെട്ടിരിക്കുന്നു. SO3 ന്റെ പോളിമർ ഘടനകൾ പരസ്പരം എളുപ്പത്തിൽ പരിവർത്തനം ചെയ്യപ്പെടുന്നു, ഖര SO3 സാധാരണയായി വിവിധ രൂപങ്ങളുടെ മിശ്രിതം ഉൾക്കൊള്ളുന്നു, ഇതിന്റെ ആപേക്ഷിക ഉള്ളടക്കം സൾഫ്യൂറിക് ആൻ\u200cഹൈഡ്രൈഡിന്റെ ഉൽ\u200cപാദന വ്യവസ്ഥകളെ ആശ്രയിച്ചിരിക്കുന്നു. ചുണങ്ങു, ഹെൽമിൻതിയാസിസ്, ഗ്രന്ഥി മുഴകൾ എന്നിവ ചികിത്സിക്കുന്നതിനായി ഇരുമ്പ് സൾഫേറ്റ് FeSO4 7H2O നേരത്തെ ഉപയോഗിച്ചിരുന്നു, ഇത് നിലവിൽ കാർഷിക കീടങ്ങളെ നിയന്ത്രിക്കാൻ ഉപയോഗിക്കുന്നു. ഗ്ലോബറിന്റെ ഉപ്പ് ”(മിറാബിലൈറ്റ്) Na2SO4 10H2O ജർമ്മൻ രസതന്ത്രജ്ഞൻ I. R. ഗ്ലോബർ സോഡിയം ക്ലോറൈഡിലെ സൾഫ്യൂറിക് ആസിഡിന്റെ പ്രവർത്തനത്തിലൂടെ ലഭിച്ചു, ഇത് വൈദ്യത്തിൽ ഒരു പോഷകസമ്പുഷ്ടമായി ഉപയോഗിക്കുന്നു.
ഇത് അസ്ഥിരമാണ്, സൾഫർ ഡൈ ഓക്സൈഡിലേക്കും വെള്ളത്തിലേക്കും വിഘടിക്കുന്നു. സൾഫ്യൂറിക് ആസിഡ് ശക്തമായ ആസിഡല്ല. ഇത് ഇടത്തരം ശക്തിയുള്ള ഒരു ആസിഡാണ്. സൾഫ്യൂറിക് ആസിഡ് മൂന്ന് തരത്തിലുള്ള പ്രതിപ്രവർത്തനങ്ങളിലേക്ക് പ്രവേശിക്കുന്നു: ആസിഡ്-ബേസ്, അയോൺ എക്സ്ചേഞ്ച്, റെഡോക്സ്. നേർപ്പിച്ച സൾഫ്യൂറിക് ആസിഡ് ഉപയോഗിച്ചാണ് ഈ പ്രതിപ്രവർത്തനങ്ങൾ നടത്തുന്നത്. അയോൺ എക്സ്ചേഞ്ച് പ്രതിപ്രവർത്തനങ്ങളാണ് സൾഫ്യൂറിക് ആസിഡിന്റെ സവിശേഷത. അസ്ഥിരമായ ആസിഡുകളുടെ ലവണങ്ങളുമായുള്ള പ്രതിപ്രവർത്തനത്തിലാണ് വാതക പരിണാമം സംഭവിക്കുന്നത്, ഇത് വാതകങ്ങൾ (കാർബോണിക്, സൾഫറസ്, ഹൈഡ്രജൻ സൾഫൈഡ്) അല്ലെങ്കിൽ ഹൈഡ്രോക്ലോറിക് പോലുള്ള അസ്ഥിര ആസിഡുകളുടെ രൂപവത്കരണത്തോടെ വിഘടിക്കുന്നു. ശ്രദ്ധിക്കുക! സ്ലൈഡ് പ്രിവ്യൂ വിവര ആവശ്യങ്ങൾക്കായി മാത്രമാണ് ഉപയോഗിക്കുന്നത്, മാത്രമല്ല എല്ലാ അവതരണ സവിശേഷതകളെക്കുറിച്ചും ഒരു ആശയം നൽകില്ല. ടാസ്ക്: സൾഫറസ് ആസിഡിന്റെ വിസർജ്ജനത്തിനായി ഒരു സമവാക്യം വരയ്ക്കുക.
SO2- നുള്ള സംവേദനക്ഷമത വ്യക്തികൾ, മൃഗങ്ങൾ, സസ്യങ്ങൾ എന്നിവയിൽ വ്യത്യാസപ്പെട്ടിരിക്കുന്നു എന്നതാണ് ശ്രദ്ധേയം. വിവിധ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ രണ്ട് സൾഫർ ആറ്റങ്ങൾ സോഡിയം തയോസൾഫേറ്റിൽ അടങ്ങിയിട്ടുണ്ട്. SO2 ഓർഗാനിക് ഡൈ ബ്ലീച്ച് ചെയ്യുന്നു, ഇത് സിൽക്ക്, കമ്പിളി, വൈക്കോൽ എന്നിവ വെളുപ്പിക്കാൻ ഉപയോഗിക്കുന്നു. സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് സൾഫറിൽ നിന്നും അപൂരിത ജൈവ സംയുക്തങ്ങളിൽ നിന്നും പെട്രോളിയം ഉൽ\u200cപന്നങ്ങൾ ശുദ്ധീകരിക്കാൻ സഹായിക്കുന്നു. ഉയർന്ന ഹൈഡ്രോസ്കോപ്പിസിറ്റി കാരണം ഇത് വാതകങ്ങൾ വരണ്ടതാക്കാനും നൈട്രിക് ആസിഡ് കേന്ദ്രീകരിക്കാനും ഉപയോഗിക്കുന്നു. ഹൈഡ്രജൻ സൾഫൈഡും സൾഫൈഡുകളും. ഹൈഡ്രജൻ സൾഫൈഡ് വെള്ളത്തിൽ ലയിക്കുമ്പോൾ ദുർബലമായ ഒരു ഹൈഡ്രജൻ സൾഫൈഡ് ആസിഡ് രൂപം കൊള്ളുന്നു, ഇവയുടെ ലവണങ്ങളെ സൾഫൈഡുകൾ എന്ന് വിളിക്കുന്നു. സൾഫ്യൂറിക് ആസിഡ് ലവണങ്ങൾ ഒരു ഡൈബാസിക് ആയി ഇടത്തരം - സൾഫൈറ്റുകൾ ആകാം, ഉദാഹരണത്തിന് സോഡിയം സൾഫൈറ്റ് Na2SO3, അസിഡിക് - ഹൈഡ്രോസൾഫൈറ്റുകൾ, ഉദാഹരണത്തിന് സോഡിയം ഹൈഡ്രോസൾഫൈറ്റ് NaHSO3. ലബോറട്ടറികളിൽ ഇത് ഒരു ലായകമായും ഉപയോഗിക്കുന്നു. ടീച്ചർ: സൾഫ്യൂറിക് ആസിഡ് ഒരു അസ്ഥിരമായ സംയുക്തമാണ്, ഇത് സൾഫർ ഡയോക്സൈഡിലേക്കും വെള്ളത്തിലേക്കും എളുപ്പത്തിൽ വിഘടിക്കുന്നു, അതിനാൽ ഇത് ജലീയ ലായനിയിൽ മാത്രമേ നിലനിൽക്കൂ. ആഗിരണം ചെയ്യുന്ന ഗോപുരത്തിൽ സൾഫർ (VI) ഓക്സൈഡ് സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ആഗിരണം ചെയ്യുന്നു. മാലിന്യങ്ങളായി വലിയ അളവിൽ രൂപം കൊള്ളുന്നതിനാൽ അന്തരീക്ഷത്തെ മലിനമാക്കുന്ന പ്രധാന വാതകങ്ങളിലൊന്നാണ് സൾഫർ ഡൈ ഓക്സൈഡ്. സൾഫർ ഓക്സൈഡ് (സൾഫർ ഡയോക്സൈഡ്, സൾഫർ ഡയോക്സൈഡ്, സൾഫർ ഡയോക്സൈഡ്) നിറമില്ലാത്ത വാതകമാണ്, സാധാരണ അവസ്ഥയിൽ മൂർച്ചയുള്ള സ്വഭാവഗുണമുണ്ട് (കത്തുന്ന പൊരുത്തത്തിന്റെ ഗന്ധത്തിന് സമാനമാണ്). ഇത് room ഷ്മാവിൽ സമ്മർദ്ദത്തിൽ ദ്രവീകരിക്കുന്നു. സൾഫർ വാതകം വെള്ളത്തിൽ ലയിക്കുന്നു, അസ്ഥിരമായ സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു. കൂടാതെ, ഈ പദാർത്ഥം സൾഫ്യൂറിക് ആസിഡ്, എത്തനോൾ എന്നിവയിൽ ലയിക്കുന്നു. അഗ്നിപർവ്വത വാതകങ്ങൾ നിർമ്മിക്കുന്ന പ്രധാന ഘടകങ്ങളിൽ ഒന്നാണിത്. സൾഫറസ് വാതകം വ്യാവസായിക രീതിയിൽ SO2 - സൾഫർ ഡയോക്സൈഡ് ലഭിക്കുന്നത് സൾഫർ കത്തുന്നതോ സൾഫൈഡുകൾ കത്തുന്നതോ ആണ് (പ്രധാനമായും പൈറൈറ്റ് ഉപയോഗിക്കുന്നു). 4FeS2 (പൈറൈറ്റ്) + 11O2 \u003d 2Fe2O3 + 8SO2 (സൾഫർ ഡയോക്സൈഡ്). ലബോറട്ടറി സാഹചര്യങ്ങളിൽ, ഹൈഡ്രോസൾഫൈറ്റുകളിലേക്കും സൾഫൈറ്റുകളിലേക്കും ശക്തമായ ആസിഡുകൾ തുറന്നുകാണിക്കുന്നതിലൂടെ സൾഫറസ് വാതകം ലഭിക്കും. ഈ സാഹചര്യത്തിൽ, തത്ഫലമായുണ്ടാകുന്ന സൾഫ്യൂറിക് ആസിഡ് ഉടൻ തന്നെ വെള്ളത്തിലേക്കും സൾഫർ ഡയോക്സൈഡിലേക്കും വിഘടിക്കുന്നു. ഉദാഹരണത്തിന്: Na2SO3 + H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) \u003d Na2SO4 + H2SO3 (സൾഫ്യൂറിക് ആസിഡ്). കുറഞ്ഞ സജീവ ലോഹങ്ങളിൽ ചൂടാക്കുമ്പോൾ സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡിന്റെ പ്രവർത്തനമാണ് സൾഫർ ഡയോക്സൈഡ് ഉത്പാദിപ്പിക്കുന്നതിനുള്ള മൂന്നാമത്തെ രീതി. ഉദാഹരണത്തിന്: Cu (ചെമ്പ്) + 2H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) \u003d CuSO4 (കോപ്പർ സൾഫേറ്റ്) + SO2 (സൾഫർ ഡയോക്സൈഡ്) + 2H2O (വെള്ളം). സൾഫർ ഡയോക്സൈഡിന്റെ രാസ ഗുണങ്ങൾ SO3 ആണ് സൾഫർ ഡയോക്സൈഡ് ഫോർമുല. ഈ പദാർത്ഥം ആസിഡ് ഓക്സൈഡുകളുടേതാണ്. 1. സൾഫർ ഡൈ ഓക്സൈഡ് വെള്ളത്തിൽ ലയിക്കുന്നു, സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു. സാധാരണ അവസ്ഥയിൽ, ഈ പ്രതികരണം പഴയപടിയാക്കാനാകും. SO2 (സൾഫർ ഡയോക്സൈഡ്) + H2O (വെള്ളം) \u003d H2SO3 (സൾഫ്യൂറസ് ആസിഡ്). 2. ക്ഷാരത്തോടൊപ്പം സൾഫർ ഡയോക്സൈഡ് സൾഫൈറ്റുകളായി മാറുന്നു. ഉദാഹരണത്തിന്: 2NaOH (സോഡിയം ഹൈഡ്രോക്സൈഡ്) + SO2 (സൾഫർ ഡയോക്സൈഡ്) \u003d Na2SO3 (സോഡിയം സൾഫൈറ്റ്) + H2O (വെള്ളം). 3. സൾഫർ ഡൈ ഓക്സൈഡിന്റെ രാസപ്രവർത്തനം വളരെ വലുതാണ്. സൾഫർ ഡയോക്സൈഡിന്റെ ഏറ്റവും കൂടുതൽ കുറയ്ക്കുന്ന ഗുണങ്ങൾ. അത്തരം പ്രതിപ്രവർത്തനങ്ങളിൽ സൾഫറിന്റെ ഓക്സീകരണത്തിന്റെ അളവ് വർദ്ധിക്കുന്നു. ഉദാഹരണത്തിന്: 1) SO2 (സൾഫർ ഡയോക്സൈഡ്) + Br2 (ബ്രോമിൻ) + 2H2O (വെള്ളം) \u003d H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) + 2HBr (ഹൈഡ്രജൻ ബ്രോമൈഡ്); 2) 2SO2 (സൾഫർ ഡയോക്സൈഡ്) + O2 (ഓക്സിജൻ) \u003d 2SO3 (സൾഫൈറ്റ്); 3) 5SO2 (സൾഫർ ഡയോക്സൈഡ്) + 2KMnO4 (പൊട്ടാസ്യം പെർമാങ്കനേറ്റ്) + 2H2O (വെള്ളം) \u003d 2H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) + 2MnSO4 (മാംഗനീസ് സൾഫേറ്റ്) + K2SO4 (പൊട്ടാസ്യം സൾഫേറ്റ്). SO2, SO3 എന്നിവയ്ക്കുള്ള ഗുണപരമായ പ്രതികരണത്തിന്റെ ഉദാഹരണമാണ് രണ്ടാമത്തെ പ്രതികരണം. വയലറ്റ് ലായനിയിലെ നിറം മാറുന്നു). 4. ശക്തമായ കുറയ്ക്കുന്ന ഏജന്റുകളുടെ സാന്നിധ്യത്തിൽ, സൾഫറസ് ആൻ\u200cഹൈഡ്രൈഡ് ഓക്സിഡൈസിംഗ് ഗുണങ്ങൾ പ്രകടിപ്പിച്ചേക്കാം. ഉദാഹരണത്തിന്, മെറ്റലർജിക്കൽ വ്യവസായത്തിലെ മാലിന്യ വാതകങ്ങളിൽ നിന്ന് സൾഫർ വേർതിരിച്ചെടുക്കുന്നതിന്, കാർബൺ മോണോക്സൈഡ് (CO) ഉപയോഗിച്ച് സൾഫർ ഡയോക്സൈഡ് കുറയ്ക്കുന്നത് ഉപയോഗിക്കുന്നു: SO2 (സൾഫർ ഡയോക്സൈഡ്) + 2CO (കാർബൺ മോണോക്സൈഡ്) \u003d 2CO2 + S (സൾഫർ). ഫോസ്ഫറസ് ആസിഡ് ലഭിക്കുന്നതിന് ഈ പദാർത്ഥത്തിന്റെ ഓക്സിഡൈസിംഗ് ഗുണങ്ങളും ഉപയോഗിക്കുന്നു: PH3 (ഫോസ്ഫൈൻ) + SO2 (സൾഫർ ഡയോക്സൈഡ്) \u003d H3PO2 (ഫോസ്ഫോറിക് ആസിഡ്) + S (സൾഫർ). സൾഫറസ് വാതകം എവിടെയാണ് ഉപയോഗിക്കുന്നത്? സൾഫർ ഡയോക്സൈഡ് പ്രധാനമായും സൾഫ്യൂറിക് ആസിഡ് ഉത്പാദിപ്പിക്കാൻ ഉപയോഗിക്കുന്നു. കുറഞ്ഞ മദ്യപാനികളുടെ (വൈൻ, മിഡിൽ പ്രൈസ് വിഭാഗത്തിലെ മറ്റ് പാനീയങ്ങൾ) ഉൽ\u200cപാദനത്തിലും ഇത് ഉപയോഗിക്കുന്നു. വിവിധ സൂക്ഷ്മാണുക്കളെ കൊല്ലാനുള്ള ഈ വാതകത്തിന്റെ സ്വത്ത് കാരണം, അവ സംഭരണ \u200b\u200bസൗകര്യങ്ങളും പച്ചക്കറി സ്റ്റോറുകളും ഉപയോഗിച്ച് നശിപ്പിക്കപ്പെടുന്നു. കൂടാതെ, കമ്പിളി, പട്ട്, വൈക്കോൽ (ക്ലോറിൻ ഉപയോഗിച്ച് ബ്ലീച്ച് ചെയ്യാൻ കഴിയാത്ത വസ്തുക്കൾ) ബ്ലീച്ച് ചെയ്യാൻ സൾഫർ ഓക്സൈഡ് ഉപയോഗിക്കുന്നു. ലബോറട്ടറികളിൽ സൾഫർ ഡയോക്സൈഡ് ഒരു ലായകമായും സൾഫർ ഡയോക്സൈഡിന്റെ വിവിധ ലവണങ്ങൾ ലഭിക്കുന്നതിനും ഉപയോഗിക്കുന്നു. ഫിസിയോളജിക്കൽ ഇഫക്റ്റുകൾ സൾഫർ വാതകത്തിന് ശക്തമായ വിഷഗുണങ്ങളുണ്ട്. ചുമ, മൂക്കൊലിപ്പ്, പരുക്കൻ സ്വഭാവം, വായിൽ വിചിത്രമായ രുചി, തൊണ്ടവേദന എന്നിവ വിഷത്തിന്റെ ലക്ഷണങ്ങളാണ്. ഉയർന്ന സാന്ദ്രതയിൽ സൾഫർ ഡയോക്സൈഡ് ശ്വസിക്കുമ്പോൾ, വിഴുങ്ങാനും ശ്വാസം മുട്ടാനും ബുദ്ധിമുട്ട്, സംസാരശേഷി, ഓക്കാനം, ഛർദ്ദി എന്നിവ ഉണ്ടാകുമ്പോൾ അക്യൂട്ട് പൾമണറി എഡിമ ഉണ്ടാകാം. സൾഫർ ഡയോക്സൈഡിന്റെ MAC: വ്യക്തികളിലും സസ്യങ്ങളിലും മൃഗങ്ങളിലും സൾഫർ ഡൈ ഓക്സൈഡിനുള്ള സംവേദനക്ഷമത വ്യത്യസ്തമാണ്. ഉദാഹരണത്തിന്, മരങ്ങൾക്കിടയിൽ, ഏറ്റവും സ്ഥിരതയുള്ളത് ഓക്ക്, ബിർച്ച് എന്നിവയാണ്, ഏറ്റവും കുറഞ്ഞത് - കൂൺ, പൈൻ എന്നിവയാണ്. ഈ ലേഖനത്തിൽ സൾഫർ ഓക്സൈഡ് എന്താണെന്നതിനെക്കുറിച്ചുള്ള വിവരങ്ങൾ നിങ്ങൾ കണ്ടെത്തും. രാസ-ഭൗതിക സ്വഭാവത്തിന്റെ പ്രധാന സവിശേഷതകൾ, നിലവിലുള്ള രൂപങ്ങൾ, അവ തയ്യാറാക്കുന്നതിനുള്ള രീതികൾ, അവ തമ്മിലുള്ള വ്യത്യാസങ്ങൾ എന്നിവ പരിഗണിക്കും. ഈ ഓക്സൈഡിന്റെ വിവിധ രൂപങ്ങളിൽ അതിന്റെ വ്യാപ്തിയും ജീവശാസ്ത്രപരമായ പങ്കും അതിൽ പരാമർശിക്കും. എന്താണ് ഒരു പദാർത്ഥം?ലളിതമായ പദാർത്ഥങ്ങളായ സൾഫറും ഓക്സിജനും ചേർന്നതാണ് സൾഫർ ഓക്സൈഡ്. കാണിച്ചിരിക്കുന്ന എസ് വലൻസിയുടെ അളവിൽ മൂന്ന് തരം സൾഫർ ഓക്സൈഡുകൾ വ്യത്യാസപ്പെട്ടിരിക്കുന്നു, അതായത്: എസ്ഒ (മോണോക്സൈഡ്, സൾഫർ മോണോക്സൈഡ്), എസ്ഒ 2 (സൾഫർ ഡയോക്സൈഡ് അല്ലെങ്കിൽ സൾഫർ ഡയോക്സൈഡ്), എസ്ഒ 3 (സൾഫർ ട്രയോക്സൈഡ് അല്ലെങ്കിൽ അൺഹൈഡ്രൈഡ്). സൾഫർ ഓക്സൈഡുകളുടെ ലിസ്റ്റുചെയ്ത എല്ലാ വ്യതിയാനങ്ങൾക്കും സമാനമായ രാസ, ശാരീരിക സവിശേഷതകൾ ഉണ്ട്. സൾഫർ മോണോക്സൈഡിനെക്കുറിച്ചുള്ള പൊതുവായ ഡാറ്റസൾഫർ, ഓക്സിജൻ എന്നീ രണ്ട് ലളിതമായ മൂലകങ്ങൾ അടങ്ങിയ അജൈവ പദാർത്ഥമാണ് ഡിവാലന്റ് സൾഫർ മോണോക്സൈഡ്, അല്ലെങ്കിൽ സൾഫർ മോണോക്സൈഡ്. സൂത്രവാക്യം SO ആണ്. സാധാരണ അവസ്ഥയിൽ, ഇത് നിറമില്ലാത്ത വാതകമാണ്, പക്ഷേ കടുത്തതും പ്രത്യേകവുമായ ദുർഗന്ധം. ജലീയ ലായനി ഉപയോഗിച്ച് പ്രതികരിക്കുന്നു. ഭൂമിയുടെ അന്തരീക്ഷത്തിലെ അപൂർവ സംയുക്തം. ഇത് താപനിലയ്ക്ക് അസ്ഥിരമാണ്, ഡൈമെറിക് രൂപത്തിൽ നിലനിൽക്കുന്നു - എസ് 2 ഒ 2. ചിലപ്പോൾ ഓക്സിജനുമായി ഇടപഴകാനും പ്രതിപ്രവർത്തനത്തിന്റെ ഫലമായി സൾഫർ ഡൈ ഓക്സൈഡ് രൂപപ്പെടാനും ഇത് പ്രാപ്തമാണ്. ഉപ്പ് രൂപപ്പെടുന്നില്ല.
സൾഫർ ഓക്സൈഡ് (2) സാധാരണയായി ലഭിക്കുന്നത് സൾഫർ കത്തിച്ചോ അല്ലെങ്കിൽ അതിന്റെ അൺഹൈഡ്രൈഡ് വിഘടിപ്പിച്ചോ ആണ്:
വെള്ളത്തിൽ, പദാർത്ഥം അലിഞ്ഞുചേരുന്നു. തൽഫലമായി, സൾഫർ ഓക്സൈഡ് തയോസൾഫ്യൂറിക് ആസിഡ് ഉണ്ടാക്കുന്നു:
സൾഫർ ഗ്യാസ് അവലോകനംSO 2 എന്ന രാസ സൂത്രവാക്യം ഉള്ള സൾഫർ ഓക്സൈഡുകളുടെ മറ്റൊരു രൂപമാണ് സൾഫർ ഓക്സൈഡ്. ഇതിന് അസുഖകരമായ നിർദ്ദിഷ്ട ദുർഗന്ധമുണ്ട്, കൂടാതെ നിറവുമില്ല. സമ്മർദ്ദത്തിന് വിധേയമാകുമ്പോൾ, അത് room ഷ്മാവിൽ കത്തിക്കാം. വെള്ളത്തിൽ ലയിക്കുമ്പോൾ അസ്ഥിരമായ സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു. ഇത് എത്തനോൾ, സൾഫ്യൂറിക് ആസിഡ് എന്നിവയുടെ ലായനിയിൽ ലയിപ്പിക്കാം. ഇത് അഗ്നിപർവ്വത വാതകത്തിന്റെ ഘടകമാണ്.
വ്യവസായത്തിൽ, സൾഫർ കത്തിച്ചോ അല്ലെങ്കിൽ അതിന്റെ സൾഫൈഡുകൾ കത്തിച്ചോ അവ ലഭിക്കും:
ലബോറട്ടറികളിൽ, ഒരു ചട്ടം പോലെ, സൾഫൈറ്റുകളും ഹൈഡ്രോസൾഫൈറ്റുകളും ഉപയോഗിച്ച് SO 2 ലഭിക്കുന്നു, അവ ശക്തമായ ആസിഡിലേക്ക് തുറന്നുകാട്ടുന്നു, കൂടാതെ കേന്ദ്രീകൃത H 2 SO 4 ന്റെ ചെറിയ അളവിലുള്ള പ്രവർത്തനമുള്ള ലോഹങ്ങൾക്കും. മറ്റ് സൾഫർ ഓക്സൈഡുകളെപ്പോലെ, SO 2 ഒരു ആസിഡ് ഓക്സൈഡാണ്. ക്ഷാരങ്ങളുമായി ഇടപഴകുകയും വിവിധ സൾഫൈറ്റുകൾ രൂപപ്പെടുകയും ചെയ്യുന്നു, ഇത് വെള്ളവുമായി പ്രതിപ്രവർത്തിച്ച് സൾഫ്യൂറിക് ആസിഡ് സൃഷ്ടിക്കുന്നു. SO 2 വളരെ സജീവമാണ്, ഇത് കുറയ്ക്കുന്ന സ്വഭാവങ്ങളിൽ ഇത് വ്യക്തമായി പ്രകടിപ്പിക്കുന്നു, അവിടെ സൾഫർ ഓക്സൈഡിന്റെ ഓക്സിഡേറ്റീവ് ഡിഗ്രി വർദ്ധിക്കുന്നു. ശക്തമായ ഒരു കുറയ്ക്കുന്ന ഏജന്റിനെ ബാധിച്ചാൽ അത് ഓക്സിഡൈസിംഗ് ഏജന്റിന്റെ ഗുണങ്ങളെ പ്രകടിപ്പിച്ചേക്കാം. ഹൈപ്പോഫോസ്ഫറസ് ആസിഡിന്റെ ഉൽ\u200cപാദനത്തിനായോ അല്ലെങ്കിൽ മെറ്റലർജിക്കൽ ഫീൽഡിലെ വാതകങ്ങളിൽ നിന്ന് എസ് വേർതിരിക്കുന്നതിനോ ആണ് രണ്ടാമത്തെ സ്വഭാവ സവിശേഷത ഉപയോഗിക്കുന്നത്. സൾഫർ ആസിഡ് അല്ലെങ്കിൽ അതിന്റെ ലവണങ്ങൾ ഉൽ\u200cപാദിപ്പിക്കാൻ സൾഫർ ഓക്സൈഡ് (4) മനുഷ്യർ വ്യാപകമായി ഉപയോഗിക്കുന്നു - ഇത് അതിന്റെ പ്രധാന പ്രയോഗ മേഖലയാണ്. വൈൻ നിർമ്മാണ പ്രക്രിയകളിലും പങ്കെടുക്കുകയും അവിടെ ഒരു പ്രിസർവേറ്റീവായി പ്രവർത്തിക്കുകയും ചെയ്യുന്നു (E220), ചിലപ്പോൾ സൂക്ഷ്മാണുക്കളെ നശിപ്പിക്കുന്നതിനാൽ പച്ചക്കറി സ്റ്റോറുകളും വെയർഹ ouses സുകളും അച്ചാറിടുന്നു. ക്ലോറിൻ ഉപയോഗിച്ച് ബ്ലീച്ച് ചെയ്യാൻ കഴിയാത്ത വസ്തുക്കളെ സൾഫർ ഓക്സൈഡ് ഉപയോഗിച്ച് ചികിത്സിക്കുന്നു.
SO 2 തികച്ചും വിഷാംശം കലർന്ന സംയുക്തമാണ്. വിഷം സൂചിപ്പിക്കുന്ന സാധാരണ ലക്ഷണങ്ങളിൽ ചുമ, ശ്വസന പ്രശ്നങ്ങൾ, സാധാരണയായി മൂക്കൊലിപ്പ്, മൂർച്ച, അസാധാരണമായ രുചി, തൊണ്ടവേദന എന്നിവ ഉൾപ്പെടുന്നു. അത്തരമൊരു വാതകം ശ്വസിക്കുന്നത് ശ്വാസംമുട്ടൽ, ഒരു വ്യക്തിയുടെ സംസാര ശേഷി, ഛർദ്ദി, വിഴുങ്ങാൻ ബുദ്ധിമുട്ട്, അക്യൂട്ട് പൾമണറി എഡിമ എന്നിവയ്ക്ക് കാരണമാകും. വർക്കിംഗ് റൂമിൽ ഈ പദാർത്ഥത്തിന്റെ പരമാവധി അനുവദനീയമായ സാന്ദ്രത 10 മില്ലിഗ്രാം / മീ 3 ആണ്. എന്നിരുന്നാലും, വ്യത്യസ്ത ആളുകളിൽ, ശരീരം സൾഫർ ഡൈ ഓക്സൈഡിനോട് വ്യത്യസ്ത സംവേദനക്ഷമത പ്രകടിപ്പിച്ചേക്കാം. സൾഫ്യൂറിക് ആൻ\u200cഹൈഡ്രൈഡിനെക്കുറിച്ചുള്ള പൊതു ഡാറ്റSO 3 എന്ന രാസ സൂത്രവാക്യം ഉള്ള ഏറ്റവും ഉയർന്ന സൾഫർ ഓക്സൈഡാണ് സൾഫർ വാതകം, അല്ലെങ്കിൽ, സൾഫ്യൂറിക് ആൻ\u200cഹൈഡ്രൈഡ്. ശ്വാസോച്ഛ്വാസം ഉള്ള ദ്രാവകം, സാധാരണ സാഹചര്യങ്ങളിൽ അസ്ഥിരമാണ്. 16.9 from C മുതൽ താഴെയുള്ള താപനിലയിൽ, ദൃ solid മായ പരിഷ്ക്കരണങ്ങളിൽ നിന്ന് സ്ഫടിക തരം മിശ്രിതങ്ങൾ രൂപപ്പെടുത്താൻ ഇതിന് കഴിയും.
ഉയർന്ന ഓക്സൈഡിന്റെ വിശദമായ വിശകലനംഉയർന്ന താപനിലയുടെ സ്വാധീനത്തിൽ വായുവുമായി SO 2 ഓക്സിഡൈസ് ചെയ്യുമ്പോൾ, ഒരു മുൻവ്യവസ്ഥ ഒരു ഉത്തേജകത്തിന്റെ സാന്നിധ്യമാണ്, ഉദാഹരണത്തിന് V 2 O 5, Fe 2 O 3, NaVO 3 അല്ലെങ്കിൽ Pt. സൾഫേറ്റുകളുടെ താപ വിഘടനം അല്ലെങ്കിൽ ഓസോണിന്റെയും SO 2 ന്റെയും പ്രതിപ്രവർത്തനം:
NO 2 ഉള്ള SO 2 ന്റെ ഓക്സീകരണം:
ഭൗതിക ഗുണപരമായ സവിശേഷതകളിൽ ഇവ ഉൾപ്പെടുന്നു: ഒരു വാതകാവസ്ഥയിൽ ഒരു തലം ഘടന, ത്രികോണ തരം, D 3 h സമമിതി എന്നിവയുടെ സാന്നിധ്യം, ഒരു വാതകത്തിൽ നിന്ന് ഒരു ക്രിസ്റ്റലിലേക്കോ ദ്രാവകത്തിലേക്കോ മാറുന്ന സമയത്ത് ഒരു ചാക്രിക ട്രൈമറും ഒരു സിഗ്സാഗ് ശൃംഖലയും ഉണ്ടാക്കുന്നു, ഒപ്പം ഒരു കോവാലന്റ് പോളാർ ബോണ്ടും ഉണ്ട്. ദൃ solid മായ രൂപത്തിൽ, SO 3 ആൽഫ, ബീറ്റ, ഗാമാ, സിഗ്മ രൂപങ്ങളിൽ സംഭവിക്കുന്നു, അതേസമയം യഥാക്രമം വ്യത്യസ്ത ദ്രവണാങ്കം, പോളിമറൈസേഷന്റെ അളവ്, വൈവിധ്യമാർന്ന സ്ഫടിക രൂപം എന്നിവയുണ്ട്. അത്തരം നിരവധി എസ്\u200cഒ 3 സ്പീഷിസുകളുടെ നിലനിൽപ്പിന് കാരണം ദാതാവ് - സ്വീകർത്താവ് ബോണ്ടുകൾ രൂപപ്പെടുന്നതാണ്. സൾഫർ ആൻ\u200cഹൈഡ്രൈഡിന്റെ ഗുണങ്ങളിൽ\u200c അതിന്റെ ഗുണങ്ങൾ\u200c ഉൾ\u200cപ്പെടുന്നു, പ്രധാനം ഇവയാണ്: ബേസുകളുമായും ഓക്സൈഡുകളുമായും സംവദിക്കാനുള്ള കഴിവ്:
ഉയർന്ന സൾഫ്യൂറിക് ഓക്സൈഡ് എസ്\u200cഒ 3 ന് വേണ്ടത്ര വലിയ പ്രവർത്തനമുണ്ട്, ഒപ്പം സൾഫ്യൂറിക് ആസിഡ് സൃഷ്ടിക്കുകയും ജലവുമായി ഇടപഴകുകയും ചെയ്യുന്നു:
ഇത് ഹൈഡ്രജൻ ക്ലോറൈഡുമായുള്ള പ്രതിപ്രവർത്തനത്തിലേക്ക് പ്രവേശിക്കുകയും ക്ലോറോസൾഫേറ്റ് ആസിഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു:
ശക്തമായ ഓക്സിഡൈസിംഗ് ഗുണങ്ങളുടെ പ്രകടനം സൾഫർ ഓക്സൈഡിന്റെ സ്വഭാവമാണ്. സൾഫ്യൂറിക് ആസിഡിന്റെ നിർമ്മാണത്തിൽ സൾഫ്യൂറിക് അൺഹൈഡ്രൈഡ് ഉപയോഗിക്കുന്നു. സൾഫർ ഡ്രാഫ്റ്റുകൾ ഉപയോഗിക്കുമ്പോൾ ഒരു ചെറിയ തുക പരിസ്ഥിതിയിലേക്ക് വിടുന്നു. നനഞ്ഞ പ്രതലവുമായുള്ള പ്രതിപ്രവർത്തനത്തിനുശേഷം സൾഫ്യൂറിക് ആസിഡ് രൂപപ്പെടുന്ന SO 3, ഫംഗസ് പോലുള്ള അപകടകരമായ ജീവികളെ നശിപ്പിക്കുന്നു. ചുരുക്കത്തിൽസൾഫർ ഓക്സൈഡ് അഗ്രഗേഷന്റെ വിവിധ സംസ്ഥാനങ്ങളിൽ ആകാം, ഇത് ഒരു ദ്രാവകത്തിൽ നിന്ന് ആരംഭിച്ച് ഖരരൂപത്തിൽ അവസാനിക്കുന്നു. ഇത് പ്രകൃതിയിൽ വളരെ അപൂർവമാണ്, മാത്രമല്ല ഇത് വ്യവസായത്തിൽ ലഭിക്കുന്നതിന് കുറച്ച് വഴികളുണ്ട്, അതുപോലെ തന്നെ അത് ഉപയോഗിക്കാൻ കഴിയുന്ന മേഖലകളും. ഓക്സൈഡിന് മൂന്ന് രൂപങ്ങളുണ്ട്, അതിൽ വ്യത്യസ്ത അളവിലുള്ള വേലൻസി കാണിക്കുന്നു. ഇത് വളരെ വിഷാംശം ഉള്ളതും ഗുരുതരമായ ആരോഗ്യ പ്രശ്നങ്ങൾക്ക് കാരണമാകുന്നതുമാണ്. സൾഫറിനായുള്ള +4 ഓക്\u200cസിഡേഷൻ നില വളരെ സ്ഥിരതയുള്ളതാണ്, ഇത് ഷാൽ 4 ടെട്രാഹാലൈഡുകൾ, എസ്\u200cഒഹാൽ 2 ഓക്\u200cസോ-ഡൈഹാലൈഡുകൾ, എസ്\u200cഒ 2 ഡയോക്സൈഡ്, അനുബന്ധ അയോണുകൾ എന്നിവയിൽ പ്രകടമാണ്. സൾഫർ ഡയോക്സൈഡിന്റെയും സൾഫർ ഡയോക്സൈഡിന്റെയും ഗുണങ്ങളെക്കുറിച്ച് നമുക്ക് പരിചയപ്പെടാം. 1.11.1. സൾഫർ ഓക്സൈഡ് (IV) സോ 2 തന്മാത്രയുടെ ഘടനSO 2 തന്മാത്രയുടെ ഘടന ഓസോൺ തന്മാത്രയുടെ ഘടനയ്ക്ക് സമാനമാണ്. സൾഫർ ആറ്റം sp 2 ഹൈബ്രിഡൈസേഷന്റെ അവസ്ഥയിലാണ്, ഭ്രമണപഥങ്ങളുടെ ആകൃതി ഒരു സാധാരണ ത്രികോണമാണ്, തന്മാത്രയുടെ ആകൃതി കോണാകൃതിയാണ്. സൾഫർ ആറ്റത്തിൽ ഒരു ഷെയർ ചെയ്യാത്ത ഇലക്ട്രോൺ ജോഡി ഉണ്ട്. S - O ബോണ്ട് നീളം 0.143 nm, വാലൻസ് ആംഗിൾ 119.5 is. ഘടന ഇനിപ്പറയുന്ന അനുരണന ഘടനകളുമായി യോജിക്കുന്നു: ഓസോണിൽ നിന്ന് വ്യത്യസ്തമായി, എസ് - ഒ ബോണ്ടിന്റെ ഗുണിതം 2 ആണ്, അതായത്, ആദ്യത്തെ അനുരണന ഘടന പ്രധാന സംഭാവന നൽകുന്നു. ഉയർന്ന താപ സ്ഥിരതയാണ് തന്മാത്രയുടെ സവിശേഷത. ഭൗതിക സവിശേഷതകൾസാധാരണ അവസ്ഥയിൽ, സൾഫർ ഡയോക്സൈഡ് അല്ലെങ്കിൽ സൾഫർ ഡയോക്സൈഡ് നിറമില്ലാത്ത വാതകമാണ്, മൂർച്ചയുള്ള ശ്വാസോച്ഛ്വാസം, ദ്രവണാങ്കം -75 ° C, ചുട്ടുതിളക്കുന്ന പോയിന്റ് -10 ° C. ഇത് വെള്ളത്തിൽ ലയിക്കുന്നു, 1 വോള്യത്തിൽ 20 ° C താപനിലയിൽ 40 വോളിയം സൾഫർ ഡൈ ഓക്സൈഡ് അലിഞ്ഞു പോകുന്നു. വിഷവാതകം. സൾഫർ ഓക്സൈഡിന്റെ (IV) രാസ ഗുണങ്ങൾസൾഫർ വാതകം വളരെ സജീവമാണ്. സൾഫർ ഡയോക്സൈഡ് ഒരു ആസിഡ് ഓക്സൈഡാണ്. ഹൈഡ്രേറ്റുകളുടെ രൂപവത്കരണത്തോടെ ഇത് വെള്ളത്തിൽ ലയിക്കുന്നു. ഇത് ഭാഗികമായി ജലവുമായി ഇടപഴകുകയും ദുർബലമായ സൾഫ്യൂറിക് ആസിഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു, ഇത് വ്യക്തിഗത രൂപത്തിൽ ഒറ്റപ്പെടില്ല: SO 2 + H 2 O \u003d H 2 SO 3 \u003d H + + HSO 3 - \u003d 2H + + SO 3 2-. വിഘടനത്തിന്റെ ഫലമായി, പ്രോട്ടോണുകൾ രൂപം കൊള്ളുന്നു, അതിനാൽ പരിഹാരത്തിന് ഒരു അസിഡിക് അന്തരീക്ഷമുണ്ട്. സോഡിയം ഹൈഡ്രോക്സൈഡിന്റെ ഒരു ലായനിയിലൂടെ വാതക സൾഫർ ഡയോക്സൈഡ് കടന്നുപോകുമ്പോൾ, സോഡിയം സൾഫൈറ്റ് രൂപം കൊള്ളുന്നു. സോഡിയം സൾഫൈറ്റ് സൾഫർ ഡയോക്സൈഡിന്റെ അധികമായി പ്രതിപ്രവർത്തിക്കുകയും സോഡിയം ഹൈഡ്രോസൾഫൈറ്റ് രൂപപ്പെടുകയും ചെയ്യുന്നു: 2NaOH + SO 2 \u003d Na 2 SO 3 + H 2 O; Na 2 SO 3 + SO 2 \u003d 2NaHSO 3. സൾഫർ വാതകത്തിന്റെ സവിശേഷത റെഡോക്സ് ദ്വൈതമാണ്, ഉദാഹരണത്തിന്, ഇത് പ്രോപ്പർട്ടികൾ കുറയ്ക്കുന്നതായി കാണിക്കുമ്പോൾ, ഇത് ബ്രോമിൻ ജലത്തെ വിസർജ്ജിക്കുന്നു: SO 2 + Br 2 + 2H 2 O \u003d H 2 SO 4 + 2HBr പൊട്ടാസ്യം പെർമാങ്കനേറ്റ് ലായനി: 5SO 2 + 2KMnO 4 + 2H 2 O \u003d 2KHSO 4 + 2MnSO 4 + H 2 SO 4. ഓക്സിജൻ ഉപയോഗിച്ച് ഓക്സീകരിക്കപ്പെട്ട സൾഫ്യൂറിക് അൺഹൈഡ്രൈഡ്: 2SO 2 + O 2 \u003d 2SO 3. ശക്തമായ കുറയ്ക്കുന്ന ഏജന്റുമാരുമായി ഇടപഴകുമ്പോൾ ഇത് ഓക്സിഡൈസിംഗ് സവിശേഷതകൾ പ്രദർശിപ്പിക്കുന്നു, ഉദാഹരണത്തിന്: SO 2 + 2CO \u003d S + 2CO 2 (500 ° C ന്, അൽ 2 O 3 ന്റെ സാന്നിധ്യത്തിൽ); SO 2 + 2H 2 \u003d S + 2H 2 O. സൾഫർ ഓക്സൈഡ് (IV) തയ്യാറാക്കൽസൾഫർ വായുവിൽ കത്തുന്നു S + O 2 \u003d SO 2. സൾഫൈഡ് ഓക്സീകരണം 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2. ലോഹ സൾഫൈറ്റുകളിൽ ശക്തമായ ആസിഡുകളുടെ പ്രഭാവം Na 2 SO 3 + 2H 2 SO 4 \u003d 2NaHSO 4 + H 2 O + SO 2. 1.11.2. സൾഫ്യൂറിക് ആസിഡും അതിന്റെ ലവണങ്ങളുംസൾഫർ ഡയോക്സൈഡ് വെള്ളത്തിൽ ലയിക്കുമ്പോൾ, ദുർബലമായ സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു, അലിഞ്ഞുപോയ SO 2 ന്റെ ഭൂരിഭാഗവും SO 2 · H 2 O ന്റെ ജലാംശം രൂപത്തിലാണ്, ക്രിസ്റ്റലിൻ ഹൈഡ്രേറ്റും തണുപ്പിക്കൽ സമയത്ത് പുറത്തുവിടുന്നു, സൾഫ്യൂറിക് ആസിഡ് തന്മാത്രകളുടെ ഒരു ചെറിയ ഭാഗം മാത്രമേ സൾഫൈറ്റ്, ഹൈഡ്രോസൾഫൈറ്റ് അയോണുകളായി വിഘടിക്കുന്നുള്ളൂ. സ്വതന്ത്ര അവസ്ഥയിൽ, ആസിഡ് വേർതിരിക്കപ്പെടുന്നില്ല. ഡൈബാസിക് ആയതിനാൽ ഇത് രണ്ട് തരം ലവണങ്ങൾ ഉണ്ടാക്കുന്നു: ഇടത്തരം - സൾഫൈറ്റുകൾ, ആസിഡ് - ഹൈഡ്രോസൾഫൈറ്റുകൾ. ക്ഷാര ലോഹ സൾഫൈറ്റുകളും ക്ഷാര, ക്ഷാര-ഭൗമ ലോഹങ്ങളുടെ ഹൈഡ്രോസൾഫൈറ്റുകളും മാത്രമേ വെള്ളത്തിൽ ലയിക്കുന്നുള്ളൂ. ഹൈഡ്രജൻ സൾഫൈഡ് - എച്ച് 2 എസ് സൾഫർ സംയുക്തങ്ങൾ -2, +4, +6. സൾഫൈഡുകൾ, സൾഫൈറ്റുകൾ, സൾഫേറ്റുകൾ എന്നിവയ്ക്കുള്ള ഗുണപരമായ പ്രതികരണങ്ങൾ. ഇടപെടൽ വഴി ലഭിച്ചു: 1. ടിയിൽ സൾഫറുള്ള ഹൈഡ്രജൻ - 300 0 2. മിനറൽ ആസിഡുകളുടെ സൾഫൈഡുകളിൽ പ്രവർത്തിക്കുമ്പോൾ: Na 2 S + 2HCl \u003d 2 NaCl + H 2 S. ഭൗതിക സവിശേഷതകൾ: നിറമില്ലാത്ത വാതകം, ചീഞ്ഞ മുട്ടയുടെ ഗന്ധം, വിഷം, വായുവിനേക്കാൾ ഭാരം, വെള്ളത്തിൽ അലിഞ്ഞു ചേർന്ന് ദുർബലമായ ഹൈഡ്രജൻ സൾഫൈഡ് ആസിഡ് രൂപപ്പെടുന്നു. രാസ ഗുണങ്ങൾ ആസിഡ്-ബേസ് പ്രോപ്പർട്ടികൾ 1. ജലത്തിലെ ഹൈഡ്രജൻ സൾഫൈഡിന്റെ ഒരു പരിഹാരം - ഹൈഡ്രജൻ സൾഫൈഡ് - ഒരു ദുർബലമായ ഡിബാസിക് ആസിഡാണ്, അതിനാൽ ഇത് പടിപടിയായി വിഘടിക്കുന്നു: H 2 S ↔ HS - + H + HS - ↔ H - + S 2- 2. സൾഫ്യൂറിക് ആസിഡിന് ആസിഡുകളുടെ പൊതു ഗുണങ്ങളുണ്ട്, ലോഹങ്ങൾ, അടിസ്ഥാന ഓക്സൈഡുകൾ, ബേസുകൾ, ലവണങ്ങൾ എന്നിവയുമായി പ്രതിപ്രവർത്തിക്കുന്നു: H 2 S + Ca \u003d CaS + H 2 H 2 S + CaO \u003d CaS + H 2 O. H 2 S + 2NaOH \u003d Na 2 S + 2H 2 O. H 2 S + CuSO 4 \u003d CuS ↓ + H 2 SO 4 എല്ലാ ആസിഡ് ലവണങ്ങൾ - ഹൈഡ്രോസൾഫൈഡുകൾ - വെള്ളത്തിൽ വളരെ ലയിക്കുന്നവയാണ്. സാധാരണ സൾഫൈഡ് ലവണങ്ങൾ വെള്ളത്തിൽ ലയിക്കുന്നു: ക്ഷാര, ക്ഷാര എർത്ത് സൾഫൈഡുകൾ എളുപ്പത്തിൽ ലയിക്കുന്നു, മറ്റ് ലോഹങ്ങളുടെ സൾഫൈഡുകൾ വെള്ളത്തിൽ ലയിക്കില്ല, കൂടാതെ ചെമ്പ്, ഈയം, മെർക്കുറി, മറ്റ് ചില ലോഹങ്ങൾ എന്നിവയുടെ സൾഫൈഡുകൾ ആസിഡുകളിൽ പോലും ലയിക്കില്ല (നൈട്രിക് ആസിഡ് ഒഴികെ) CuS + 4HNO 3 \u003d Cu (NO 3) 2 + 3S + 2NO + 2H 2 O. ലയിക്കുന്ന സൾഫൈഡുകൾ ജലവിശ്ലേഷണത്തിന് വിധേയമാകുന്നു - അയോൺ. Na 2 S ↔ 2Na + + S 2- S 2- + HOH ↔HS - + OH - Na 2 S + Н 2 О ↔ NaНS + NaOH ഹൈഡ്രജൻ സൾഫൈഡ് ആസിഡിനും അതിന്റെ ലയിക്കുന്ന ലവണങ്ങൾക്കുമുള്ള ഒരു ഗുണപരമായ പ്രതികരണം (അതായത്, സൾഫൈഡ് അയോൺ എസ് 2- ലേക്ക്) ലയിക്കുന്ന ലീഡ് ലവണങ്ങളുമായുള്ള പ്രതിപ്രവർത്തനമാണ്, കൂടാതെ ഒരു കറുത്ത പിബിഎസ് പ്രിസിപൈറ്റ് രൂപം കൊള്ളുന്നു Na 2 S + Pb (NO 3) 2 \u003d 2NaNO 3 + PbS Pb 2+ + S 2- \u003d PbS
ഇത് പ്രോപ്പർട്ടികൾ കുറയ്ക്കുന്നതായി മാത്രം കാണിക്കുന്നു, കാരണം സൾഫർ ആറ്റത്തിന് താഴ്ന്ന ഓക്സിഡേഷൻ അവസ്ഥ -2 ഉണ്ട് 1. ഓക്സിജനുമായി a) ഒരു പോരായ്മയോടെ 2H 2 S -2 + O 2 0 \u003d S 0 + 2H 2 O -2 b) അധിക ഓക്സിജനുമായി 2H 2 S + 3O 2 \u003d 2SO 2 + 2H 2 O. 2. ഹാലോജൻ ഉപയോഗിച്ച് (ബ്രോമിൻ വെള്ളം ബ്ലീച്ചിംഗ്) H 2 S -2 + Br 2 \u003d S 0 + 2HBr -1 3. കോൺ. HNO 3 H 2 S + 2HNO 3 (q) \u003d S + 2NO 2 + 2H 2 O. b) ശക്തമായ ഓക്സിഡൈസിംഗ് ഏജന്റുമാരുമൊത്ത് (KMnO 4, K2 CrO 4 ഒരു അസിഡിക് അന്തരീക്ഷത്തിൽ) 2KMnO 4 + 3H 2 SO 4 + 5H 2 S \u003d 5S + 2MnSO 4 + K 2 SO 4 + 8H 2 O c) ഹൈഡ്രജൻ സൾഫൈഡ് ആസിഡ് ശക്തമായ ഓക്സിഡൈസിംഗ് ഏജന്റുകൾ മാത്രമല്ല, ദുർബലരായവയും ഓക്സീകരിക്കപ്പെടുന്നു, ഉദാഹരണത്തിന്, ഇരുമ്പിന്റെ ലവണങ്ങൾ (III), സൾഫറസ് ആസിഡ് മുതലായവ. 2FeCl 3 + H 2 S \u003d 2FeCl 2 + S + 2HCl H 2 SO 3 + 2H 2 S \u003d 3S + 3H 2 O. ലഭിക്കുന്നു 1. ഓക്സിജനിൽ സൾഫർ കത്തിക്കുന്നത്. O 2 ൽ കൂടുതലുള്ള ഹൈഡ്രജൻ സൾഫൈഡിന്റെ ജ്വലനം 2H 2 S + 3O 2 \u003d 2SO 2 + 2H 2 O. 3. സൾഫൈഡുകളുടെ ഓക്സീകരണം 2CuS + 3O 2 \u003d 2SO 2 + 2CuO 4. ആസിഡുകളുമായുള്ള സൾഫൈറ്റുകളുടെ പ്രതിപ്രവർത്തനം Na 2 SO 3 + H 2 SO 4 \u003d Na 2 SO 4 + SO 2 + H 2 O. 5. (എച്ച് 2) ന് ശേഷമുള്ള ഒരു ശ്രേണിയിലെ ലോഹങ്ങളുടെ പ്രതിപ്രവർത്തനം കോൺ. H 2 SO 4 Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 O. ഭൗതിക സവിശേഷതകൾ നിറമില്ലാതെ, കരിഞ്ഞ സൾഫറിന്റെ ശ്വാസോച്ഛ്വാസം ഉള്ള വാതകം വിഷമാണ്, വായുവിനേക്കാൾ ഭാരം 2 മടങ്ങ് കൂടുതലാണ്, ഇത് വെള്ളത്തിൽ ലയിക്കുന്നു (room ഷ്മാവിൽ 40 വോളിയം വാതകം ഒരു അളവിൽ അലിഞ്ഞുപോകുന്നു). രാസ ഗുണങ്ങൾ: ആസിഡ്-ബേസ് പ്രോപ്പർട്ടികൾ SO 2 ഒരു സാധാരണ ആസിഡ് ഓക്സൈഡാണ്. 1. ക്ഷാരങ്ങളോടെ, രണ്ട് തരം ലവണങ്ങൾ ഉണ്ടാക്കുന്നു: സൾഫൈറ്റുകൾ, ഹൈഡ്രോസൾഫൈറ്റുകൾ 2KOH + SO 2 \u003d K 2 SO 3 + H 2 O. KOH + SO 2 \u003d KНSO 3 + H 2 O. 2. അടിസ്ഥാന ഓക്സൈഡുകൾക്കൊപ്പം K 2 O + SO 2 \u003d K 2 SO 3 3. ദുർബലമായ സൾഫ്യൂറിക് ആസിഡ് വെള്ളത്തിൽ രൂപം കൊള്ളുന്നു H 2 O + SO 2 \u003d H 2 SO 3 സൾഫ്യൂറിക് ആസിഡ് ലായനിയിൽ മാത്രമേ നിലനിൽക്കുന്നുള്ളൂ, ദുർബലമായ ആസിഡാണ്, ആസിഡുകളുടെ എല്ലാ പൊതു ഗുണങ്ങളും ഉണ്ട്. 4. സൾഫൈറ്റിനോടുള്ള ഉയർന്ന നിലവാരമുള്ള പ്രതികരണം - അയോൺ - എസ്ഒ 3 2 - മിനറൽ ആസിഡുകളുടെ പ്രഭാവം Na 2 SO 3 + 2HCl \u003d 2Na 2 Cl + SO 2 + H 2 O കരിഞ്ഞ സൾഫറിന്റെ മണം റെഡോക്സ് പ്രോപ്പർട്ടികൾ OVR ൽ, ഇത് ഒരു ഓക്സിഡൈസിംഗ് ഏജന്റ് അല്ലെങ്കിൽ കുറയ്ക്കുന്ന ഏജന്റ് ആകാം, കാരണം SO 2 ലെ സൾഫർ ആറ്റത്തിന് +4 എന്ന ഇന്റർമീഡിയറ്റ് ഓക്സിഡേഷൻ അവസ്ഥയുണ്ട്. ഓക്സിഡൈസിംഗ് ഏജന്റ് എന്ന നിലയിൽ: SO 2 + 2H 2 S \u003d 3S + 2H 2 S. കുറയ്ക്കുന്ന ഏജന്റ് എന്ന നിലയിൽ: 2SO 2 + O 2 \u003d 2SO 3 Cl 2 + SO 2 + 2H 2 O \u003d H 2 SO 4 + 2HCl 2KMnO 4 + 5SO 2 + 2H 2 O \u003d K 2 SO 4 + 2H 2 SO 4 + 2MnSO 4 സൾഫർ ഓക്സൈഡ് (VI) SO 3 (സൾഫ്യൂറിക് അൺഹൈഡ്രൈഡ്) സ്വീകരിക്കുന്നു: സൾഫർ ഓക്സീകരണം 2SO 2 + O 2 \u003d 2SO 3 ( t 0, കാറ്റ്) ഭൗതിക സവിശേഷതകൾ നിറമില്ലാത്ത ദ്രാവകം, 17 0 C യിൽ താഴെയുള്ള താപനിലയിൽ ഒരു വെളുത്ത സ്ഫടിക പിണ്ഡമായി മാറുന്നു. താപ അസ്ഥിരമായ സംയുക്തം 700 0 at ന് പൂർണ്ണമായും വിഘടിപ്പിക്കുന്നു. ഇത് വെള്ളത്തിൽ ലയിക്കുന്നതാണ്, അൺ\u200cഹൈഡ്രസ് സൾഫ്യൂറിക് ആസിഡിൽ, ഒപ്പം ഓലിയം രൂപപ്പെടുന്നതുമായി പ്രതിപ്രവർത്തിക്കുന്നു SO 3 + H 2 SO 4 \u003d H 2 S 2 O 7 രാസ ഗുണങ്ങൾ ആസിഡ്-ബേസ് പ്രോപ്പർട്ടികൾ സാധാരണ ആസിഡ് ഓക്സൈഡ്. 1. ക്ഷാരത്തോടൊപ്പം രണ്ട് തരം ലവണങ്ങൾ രൂപപ്പെടുന്നു: സൾഫേറ്റുകളും ഹൈഡ്രോസൾഫേറ്റുകളും 2KOH + SO 3 \u003d K 2 SO 4 + H 2 O. KOH + SO 3 \u003d KНSO 4 + H 2 O. 2. അടിസ്ഥാന ഓക്സൈഡുകൾക്കൊപ്പം CaO + SO 2 \u003d CaSO 4 3. വെള്ളത്തിൽ H 2 O + SO 3 \u003d H 2 SO 4 റെഡോക്സ് പ്രോപ്പർട്ടികൾ സൾഫർ ഓക്സൈഡ് (VI) ശക്തമായ ഓക്സിഡൈസിംഗ് ഏജന്റാണ്, ഇത് സാധാരണയായി SO 2 ആയി കുറയുന്നു 3SO 3 + H 2 S \u003d 4SO 2 + H 2 O. സൾഫ്യൂറിക് ആസിഡ് H 2 SO 4 സൾഫ്യൂറിക് ആസിഡ് ഉത്പാദനം വ്യവസായത്തിൽ, സമ്പർക്കത്തിലൂടെ ആസിഡ് ഉത്പാദിപ്പിക്കപ്പെടുന്നു: 1. പൈറൈറ്റ് ഫയറിംഗ് 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2 2. SO 2 മുതൽ SO 3 വരെ ഓക്സീകരണം 2SO 2 + O 2 \u003d 2SO 3 ( t 0, കാറ്റ്) 3. സൾഫ്യൂറിക് ആസിഡിൽ SO 3 പിരിച്ചുവിടൽ nSO 3 + H 2 SO 4 \u003d H 2 SO 4 nSO 3 (ഓലിയം) H 2 SO 4 nSO 3 + H 2 O \u003d H 2 SO 4 ഭൗതിക സവിശേഷതകൾ H 2 SO 4 - കനത്ത എണ്ണമയമുള്ള ദ്രാവകം, മണമില്ലാത്തതും നിറവും, ഹൈഗ്രോസ്കോപ്പിക്. ഇത് ഏതുവിധേനയും വെള്ളത്തിൽ കലരുന്നു, ഒരു സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് വെള്ളത്തിൽ ലയിക്കുമ്പോൾ, ഒരു വലിയ അളവിൽ ചൂട് പുറത്തുവിടുന്നു, അതിനാൽ ഇത് ശ്രദ്ധാപൂർവ്വം വെള്ളത്തിൽ ഒഴിക്കണം, തിരിച്ചും അല്ല (ആദ്യത്തെ വെള്ളം, പിന്നെ ആസിഡ്, അല്ലെങ്കിൽ ഒരു വലിയ ദുരന്തം സംഭവിക്കും) 70% ൽ താഴെയുള്ള എച്ച് 2 എസ്ഒ 4 ഉള്ളടക്കമുള്ള വെള്ളത്തിൽ സൾഫ്യൂറിക് ആസിഡിന്റെ ഒരു പരിഹാരത്തെ സാധാരണയായി ഡില്യൂട്ട് സൾഫ്യൂറിക് ആസിഡ് എന്ന് വിളിക്കുന്നു, ഇത് 70 ശതമാനത്തിൽ കൂടുതൽ കേന്ദ്രീകരിക്കുന്നു. രാസ ഗുണങ്ങൾ ആസിഡ് ബേസ് നേർപ്പിച്ച സൾഫ്യൂറിക് ആസിഡ് ശക്തമായ ആസിഡുകളുടെ എല്ലാ സ്വഭാവഗുണങ്ങളും പ്രദർശിപ്പിക്കുന്നു. ജലീയ ലായനിയിൽ വിഘടിക്കുന്നു: H 2 SO 4 ↔ 2H + + SO 4 2- 1. അടിസ്ഥാന ഓക്സൈഡുകൾക്കൊപ്പം MgO + H 2 SO 4 \u003d MgSO 4 + H 2 O. 2. അടിസ്ഥാനം 2NaOH + H 2 SO 4 \u003d Na 2 SO 4 + 2H 2 O. 3. ലവണങ്ങൾ ഉപയോഗിച്ച് BaCl 2 + H 2 SO 4 \u003d BaSO 4 ↓ + 2HCl Ba 2+ + SO 4 2- \u003d BaSO 4 ↓ (വൈറ്റ് പ്രിസിപൈറ്റ്) സൾഫേറ്റ് അയോണിനുള്ള ഗുണപരമായ പ്രതികരണം SO 4 2- ഉയർന്ന തിളപ്പിക്കൽ കാരണം മറ്റ് ആസിഡുകളുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ സൾഫ്യൂറിക് ആസിഡ് ചൂടാകുമ്പോൾ ലവണങ്ങളിൽ നിന്ന് അവയെ സ്ഥാനഭ്രഷ്ടനാക്കുന്നു: NaCl + H 2 SO 4 \u003d HCl + NaHSO 4 റെഡോക്സ് പ്രോപ്പർട്ടികൾ H 2 SO 4 നേർപ്പിക്കുന്നതിൽ, ഓക്സിഡൈസിംഗ് ഏജന്റുകൾ H + അയോണുകളും സാന്ദ്രീകൃത സൾഫേറ്റിൽ SO 4 2 അയോണുകളുമാണ് നേർപ്പിച്ച സൾഫ്യൂറിക് ആസിഡിൽ, ഹൈഡ്രജനുമായി തുടർച്ചയായി പ്രവർത്തിക്കുന്ന ലോഹങ്ങൾ അലിഞ്ഞുചേരുന്നു, അതേസമയം സൾഫേറ്റുകൾ രൂപപ്പെടുകയും ഹൈഡ്രജൻ പുറത്തുവിടുകയും ചെയ്യുന്നു Zn + H 2 SO 4 \u003d ZnSO 4 + H 2 സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ഒരു get ർജ്ജമേറിയ ഓക്സിഡൈസിംഗ് ഏജന്റാണ്, പ്രത്യേകിച്ച് ചൂടാക്കുമ്പോൾ. ഇത് നിരവധി ലോഹങ്ങൾ, നോൺ-ലോഹങ്ങൾ, അജൈവ, ജൈവ വസ്തുക്കളെ ഓക്സിഡൈസ് ചെയ്യുന്നു. H 2 SO 4 (k) ഓക്സിഡൈസർ S +6 കൂടുതൽ സജീവമായ ലോഹങ്ങൾ ഉപയോഗിച്ച്, സാന്ദ്രതയെ ആശ്രയിച്ച് സൾഫ്യൂറിക് ആസിഡ് വിവിധ ഉൽപ്പന്നങ്ങളിലേക്ക് കുറയ്ക്കാൻ കഴിയും. Zn + 2H 2 SO 4 \u003d ZnSO 4 + SO 2 + 2H 2 O. 3Zn + 4H 2 SO 4 \u003d 3ZnSO 4 + S + 4H 2 O. 4Zn + 5H 2 SO 4 \u003d 4ZnSO 4 + H 2 S + 4H 2 O. സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ചില ലോഹങ്ങളല്ലാത്തവയെ (സൾഫർ, കാർബൺ, ഫോസ്ഫറസ് മുതലായവ) ഓക്സീകരിക്കുകയും സൾഫർ ഓക്സൈഡിലേക്ക് (IV) കുറയ്ക്കുകയും ചെയ്യുന്നു. S + 2H 2 SO 4 \u003d 3SO 2 + 2H 2 O. C + 2H 2 SO 4 \u003d 2SO 2 + CO 2 + 2H 2 O. ചില സങ്കീർണ്ണ വസ്തുക്കളുമായുള്ള ഇടപെടൽ H 2 SO 4 + 8HI \u003d 4I 2 + H 2 S + 4 H 2 O. H 2 SO 4 + 2HBr \u003d Br 2 + SO 2 + 2H 2 O. സൾഫ്യൂറിക് ആസിഡ് ലവണങ്ങൾ 2 തരം ലവണങ്ങൾ: സൾഫേറ്റുകളും ഹൈഡ്രോസൾഫേറ്റുകളും സൾഫ്യൂറിക് ആസിഡ് ലവണങ്ങൾക്ക് ലവണങ്ങളുടെ എല്ലാ പൊതു ഗുണങ്ങളും ഉണ്ട്. ചൂടാക്കാനുള്ള അവരുടെ ബന്ധമാണ് പ്രത്യേകത. സജീവ ലോഹങ്ങളുടെ സൾഫേറ്റുകൾ (Na, K, Ba) 1000 0 above ന് മുകളിൽ ചൂടാക്കുമ്പോഴും വിഘടിക്കുന്നില്ല, കുറഞ്ഞ സജീവ ലോഹങ്ങളുടെ ലവണങ്ങൾ (അൽ, ഫെ, ക്യു) നേരിയ ചൂടിൽ പോലും വിഘടിക്കുന്നു |
ജനപ്രിയമായത്:
പുതിയത്
- മെറ്റൽ ഘടനകളുടെ ഇൻസ്റ്റാളേഷൻ ചെലവ്
- ഒരു കവർച്ച അലാറത്തിനായി ബജറ്റ് ചെയ്യുന്നതിന്റെ ഉദാഹരണം ഒരു ഫയർ അലാറത്തിനായി എങ്ങനെ ബജറ്റ് ചെയ്യാം
- കമ്മീഷനിംഗ്: ഓർഗനൈസേഷൻ, നടപ്പാക്കൽ, പ്രോഗ്രാം, കമ്മീഷൻ ചെയ്യുന്നതിനുള്ള ചെലവ്
- എഞ്ചിനീയറിംഗ് സിസ്റ്റങ്ങൾക്കായുള്ള ഓട്ടോമേറ്റഡ് കൺട്രോൾ യൂണിറ്റുകൾ: ചൂടാക്കാനായി ഓട്ടോമേറ്റഡ് കൺട്രോൾ യൂണിറ്റുകളുടെ എംകെഡി സ്കീമുകളുടെ ഒരു ഓവർഹോൾ ആസൂത്രണം ചെയ്യുമ്പോൾ നിങ്ങൾ അറിയേണ്ടത്
- ബീജസങ്കലനത്തിലൂടെ തകർന്ന കല്ല് പാളികളുടെ നിർമ്മാണം
- തോടുകളുടെ മതിലുകൾ ഉറപ്പിക്കുന്നു ട്രെഞ്ചിന്റെ മതിലുകൾ ഉറപ്പിക്കുന്നതിനുള്ള പ്ലാസ്റ്റിക് പരിചകൾ
- സുഷിരങ്ങളുള്ള പ്ലാസ്റ്റർ കോർണർ എങ്ങനെ ഉപയോഗിക്കാം പ്ലാസ്റ്റേർഡ് കോണുകളിൽ സുഷിര കോണുകൾ ഇൻസ്റ്റാൾ ചെയ്യുന്നു
- ഗ്യാസ് പരവതാനിയുടെ ഉദ്ദേശ്യം ഗ്യാസ് പൈപ്പ്ലൈൻ ഡ്രോയിംഗിൽ ഒരു പരവതാനി സ്ഥാപിക്കൽ
- പരവതാനി പന്നി-ഇരുമ്പ് വെള്ളം KCHV-V (D400) ഉപകരണങ്ങളുടെ ഉദ്ദേശ്യവും പരവതാനികളുടെ ഇൻസ്റ്റാളേഷനും
- ഒരു ഫയർ അലാറം ഇൻസ്റ്റാൾ ചെയ്യുന്നതിനുള്ള ശരിയായ എസ്റ്റിമേറ്റ് ഞങ്ങൾ തയ്യാറാക്കുന്നു