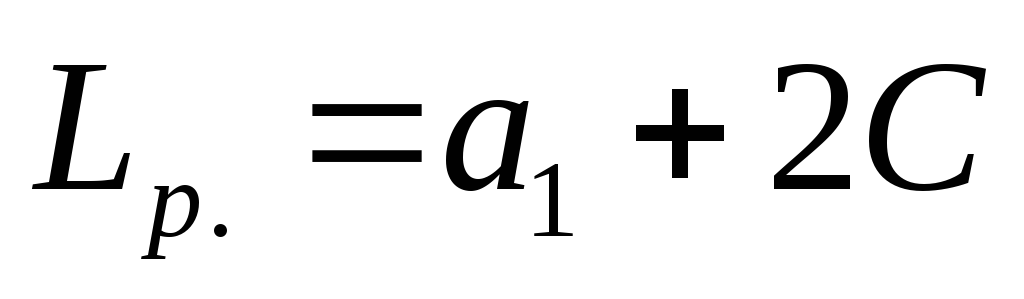സൈറ്റ് വിഭാഗങ്ങൾ
എഡിറ്റർ\u200cമാരുടെ ചോയ്\u200cസ്:
- ഡ്രൈവ്\u200cവാളിന് കീഴിൽ ഒരു പ്രൊഫൈൽ എങ്ങനെ ഉറപ്പിക്കാം, നഖങ്ങളുള്ള ഡോവൽ എന്നിവ ഉപയോഗിച്ച് സസ്പെൻഡ് ചെയ്ത സീലിംഗിന്റെ നേരിട്ടുള്ള ഇൻസ്റ്റാളേഷൻ
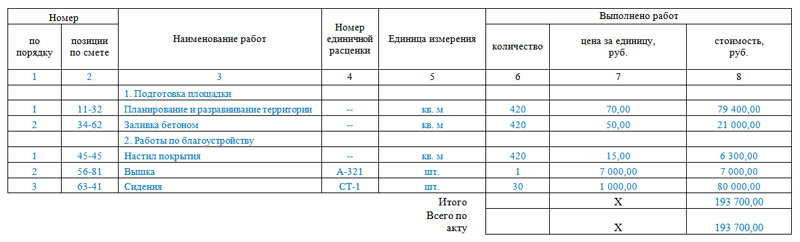
- ഒരു യന്ത്ര ഉപകരണത്തിന്റെ വിലയിരുത്തലിനെക്കുറിച്ചുള്ള റിപ്പോർട്ടിന്റെ ഉദാഹരണം
- ഒരു സ്വകാര്യ വീടിനെ കേന്ദ്ര മലിനജല ശൃംഖലയുമായി എങ്ങനെ ബന്ധിപ്പിക്കാം സ്വകാര്യ മലിനജലം എന്ത് രേഖകളാണ് വേണ്ടത്
- കെട്ടിട ഘടനകളിലേക്ക് വിവിധ തരം പൈപ്പ്ലൈനുകൾ അറ്റാച്ചുചെയ്യുന്നു
- കെട്ടിട ഘടനകളിലേക്ക് വിവിധ തരം പൈപ്പ്ലൈനുകൾ അറ്റാച്ചുചെയ്യുന്നു
- ഒരു അപ്പാർട്ട്മെന്റ് കെട്ടിടത്തിന്റെ പ്രവേശന കവാടത്തിന്റെ അറ്റകുറ്റപ്പണി
- കോൺക്രീറ്റിംഗ് അയവുള്ള ഗുണകം
- വാൾപേപ്പർ പെയിന്റിംഗ്: ഒരു ചതുരശ്ര മീറ്ററിന് ജോലിയുടെ ചെലവ്
- കേബിൾ ക്ലിപ്പ് - സ്റ്റെയിൻലെസ് സ്റ്റീൽ മൂലകങ്ങളുടെ പ്രധാന തരങ്ങൾ, ആപ്ലിക്കേഷനും പ്രോസസ്സിംഗും (75 ഫോട്ടോകൾ) കേബിൾ ടെൻഷൻ
- കേബിൾ ക്ലിപ്പ് - സ്റ്റെയിൻലെസ് സ്റ്റീൽ മൂലകങ്ങളുടെ പ്രധാന തരങ്ങൾ, ആപ്ലിക്കേഷനും പ്രോസസ്സിംഗും (75 ഫോട്ടോകൾ) ധ്രുവത്തിലേക്ക് കേബിൾ ഉറപ്പിക്കുന്നതിനുള്ള രീതികൾ
പരസ്യംചെയ്യൽ
| സൾഫർ സംയുക്തങ്ങളുടെ രാസ ഗുണങ്ങൾ. പ്രകൃതിയിലും മനുഷ്യജീവിതത്തിലും സൾഫർ ഓക്സൈഡ് |
4.ഡോക്സൾഫർ. ഹൈഡ്രജൻ സൾഫൈഡ്, സൾഫൈഡുകൾ, ഹൈഡ്രോസൾഫൈഡുകൾ. സൾഫർ ഓക്സൈഡുകൾ (IV), (VI). സൾഫ്യൂറിക്, സൾഫ്യൂറിക് ആസിഡുകളും അവയുടെ ലവണങ്ങളും. സൾഫ്യൂറിക് ആസിഡ് എസ്റ്ററുകൾ. സോഡിയം തയോസൾഫേറ്റ് 4.1. സൾഫർ
നിരവധി സഹസ്രാബ്ദങ്ങളായി ആളുകൾ ഉപയോഗിക്കുന്ന ചുരുക്കം രാസ ഘടകങ്ങളിൽ ഒന്നാണ് സൾഫർ. ഇത് പ്രകൃതിയിൽ വ്യാപകമാണ്, ഇത് ഒരു സ്വതന്ത്ര അവസ്ഥയിലും (നേറ്റീവ് സൾഫർ) സംയുക്തങ്ങളിലും കാണപ്പെടുന്നു. സൾഫർ അടങ്ങിയ ധാതുക്കളെ സൾഫൈഡുകൾ (പൈറൈറ്റുകൾ, ഗ്ലോസ്സ്, ബ്ലെൻഡെ), സൾഫേറ്റുകൾ എന്നിങ്ങനെ രണ്ടായി തിരിക്കാം. ഇറ്റലിയിലും (സിസിലി ദ്വീപ്) യുഎസ്എയിലും പ്രാദേശിക സൾഫർ വലിയ അളവിൽ കാണപ്പെടുന്നു. സി\u200cഐ\u200cഎസിൽ, വോൾഗ മേഖലയിലും മധ്യേഷ്യയിലെ സംസ്ഥാനങ്ങളിലും ക്രിമിയയിലും മറ്റ് പ്രദേശങ്ങളിലും നേറ്റീവ് സൾഫർ നിക്ഷേപം കാണപ്പെടുന്നു. ആദ്യ ഗ്രൂപ്പിലെ ധാതുക്കളിൽ പിബിഎസിന്റെ ലീഡ് തിളക്കം, ക്യു 2 എസിന്റെ ചെമ്പ് തിളക്കം, ആഗ് 2 എസിന്റെ വെള്ളി തിളക്കം, സിഎൻഎസിന്റെ സിങ്ക് മോഹം, സിഡിഎസിന്റെ കാഡ്മിയം മിശ്രിതം, ഫെസ് 2 ന്റെ പൈറൈറ്റ് അല്ലെങ്കിൽ ഇരുമ്പ് ചെഡ്ഡാൻ, കുഫെസ് 2 ന്റെ ചാൽകോപ്പൈറൈറ്റ്, സിന്നാബാർ - എച്ച്ജിഎസ്. രണ്ടാമത്തെ ഗ്രൂപ്പിലെ ധാതുക്കളിൽ ജിപ്സം CaSO 4 2H 2 O, മിറാബിലൈറ്റ് (ഗ്ലൗബറിന്റെ ഉപ്പ്) - Na 2 SO 4 10H 2 O, കിസെറൈറ്റ് - MgSO 4 H 2 O. പ്രോട്ടീൻ തന്മാത്രകളുടെ ഭാഗമായതിനാൽ മൃഗങ്ങളുടെയും സസ്യങ്ങളുടെയും ജീവികളിൽ സൾഫർ കാണപ്പെടുന്നു. ജൈവ സൾഫർ സംയുക്തങ്ങൾ എണ്ണയിൽ കാണപ്പെടുന്നു. നേടുന്നു 1. പ്രകൃതിദത്ത സംയുക്തങ്ങളിൽ നിന്ന് സൾഫർ ലഭിച്ചുകഴിഞ്ഞാൽ, ഉദാഹരണത്തിന് പൈറൈറ്റുകളിൽ നിന്ന് ഇത് ഉയർന്ന താപനിലയിലേക്ക് ചൂടാക്കപ്പെടുന്നു. ഇരുമ്പ് (II) സൾഫൈഡ്, സൾഫർ എന്നിവയുടെ രൂപവത്കരണത്തോടെ സൾഫർ പൈറൈറ്റുകൾ വിഘടിക്കുന്നു: 2. പ്രതിപ്രവർത്തനത്തിലൂടെ ഓക്സിജന്റെ അഭാവം ഉള്ള ഹൈഡ്രജൻ സൾഫൈഡിന്റെ ഓക്സീകരണം വഴി സൾഫർ ലഭിക്കും: 2H 2 S + O 2 \u003d 2S + 2H 2 O. 3. നിലവിൽ, സൾഫർ ഡയോക്സൈഡ് എസ്ഒ 2 ന്റെ കാർബൺ കുറയ്ക്കുന്നതിലൂടെ സൾഫർ ലഭിക്കുന്നത് സാധാരണമാണ് - സൾഫർ അയിരുകളിൽ നിന്ന് ലോഹങ്ങൾ ഉരുകുന്നതിന്റെ ഉപോൽപ്പന്നം: SO 2 + C \u003d CO 2 + S. മെറ്റലർജിക്കൽ, കോക്ക് ഓവനുകളിലെ മാലിന്യ വാതകങ്ങളിൽ സൾഫർ ഡയോക്സൈഡും ഹൈഡ്രജൻ സൾഫൈഡും അടങ്ങിയിരിക്കുന്നു. ഈ മിശ്രിതം ഉയർന്ന താപനിലയിൽ കാറ്റലിസ്റ്റിന് മുകളിലൂടെ കടന്നുപോകുന്നു: H 2 S + SO 2 \u003d 2H 2 O + 3S ^ ഭൗതിക സവിശേഷതകൾ പൊട്ടുന്ന നാരങ്ങ മഞ്ഞ സോളിഡാണ് സൾഫർ. ഇത് പ്രായോഗികമായി വെള്ളത്തിൽ ലയിക്കില്ല, പക്ഷേ ഇത് കാർബൺ ഡൈസൾഫൈഡ് സി\u200cഎസ് 2 അനിലൈനിലും മറ്റ് ചില ലായകങ്ങളിലും നന്നായി ലയിക്കുന്നു. ഇത് ചൂടും വൈദ്യുത പ്രവാഹവും മോശമായി നടത്തുന്നു. സൾഫർ നിരവധി അലോട്രോപിക് പരിഷ്കാരങ്ങൾ സൃഷ്ടിക്കുന്നു: 1 . ^ റോംബിക് സൾഫർ (ഏറ്റവും സ്ഥിരതയുള്ളത്), പരലുകൾ ഒക്ടാഹെഡ്ര പോലെ കാണപ്പെടുന്നു. സൾഫർ ചൂടാക്കുമ്പോൾ, അതിന്റെ നിറവും വിസ്കോസിറ്റി മാറുന്നു: ആദ്യം അത് ഇളം മഞ്ഞയായി മാറുന്നു, തുടർന്ന് താപനില ഉയരുമ്പോൾ അത് ഇരുണ്ടതായിത്തീരുകയും ട്യൂബിൽ നിന്ന് പുറത്തേക്ക് ഒഴുകാതിരിക്കുകയും ചെയ്യുന്നു, കൂടുതൽ ചൂടാക്കുമ്പോൾ, വിസ്കോസിറ്റി വീണ്ടും കുറയുന്നു, 444, 6 С സൾഫർ തിളപ്പിക്കുന്നു. 2. ^ മോണോക്ലിനിക് സൾഫർ - ഇരുണ്ട മഞ്ഞ സൂചി പരലുകളുടെ രൂപത്തിൽ മാറ്റം വരുത്തുക, ഉരുകിയ സൾഫറിന്റെ വേഗത കുറയ്ക്കുക. 3. പ്ലാസ്റ്റിക് സൾഫർഒരു തിളപ്പിച്ച് ചൂടാക്കിയ സൾഫർ തണുത്ത വെള്ളത്തിൽ ഒഴിച്ചാൽ ഇത് രൂപം കൊള്ളുന്നു. റബ്ബർ പോലെ നീട്ടാൻ എളുപ്പമാണ് (ചിത്രം 19 കാണുക). പ്രകൃതിദത്ത സൾഫറിൽ നാല് സ്ഥിരതയുള്ള ഐസോടോപ്പുകളുടെ മിശ്രിതം അടങ്ങിയിരിക്കുന്നു: 32 16 എസ്, 33 16 എസ്, 34 16 എസ്, 36 16 എസ്. ^ രാസ ഗുണങ്ങൾ അപൂർണ്ണമായ ബാഹ്യ energy ർജ്ജ നിലയുള്ള ഒരു സൾഫർ ആറ്റത്തിന് രണ്ട് ഇലക്ട്രോണുകൾ അറ്റാച്ചുചെയ്യാനും ഒരു ഡിഗ്രി പ്രദർശിപ്പിക്കാനും കഴിയും
ഓക്സിഡേഷൻ -2. ലോഹങ്ങളും ഹൈഡ്രജനും (Na 2 S, H 2 S) സംയുക്തങ്ങളിൽ സൾഫർ ഈ ഓക്സീകരണ അവസ്ഥ കാണിക്കുന്നു. കൂടുതൽ ഇലക്ട്രോ നെഗറ്റീവ് മൂലകത്തിന്റെ ആറ്റത്തിലേക്ക് ഇലക്ട്രോണുകൾ സംഭാവന ചെയ്യുമ്പോഴോ വലിക്കുമ്പോഴോ സൾഫർ ഓക്സീകരണത്തിന്റെ അളവ് +2, +4, +6 ആകാം. തണുപ്പിൽ സൾഫർ താരതമ്യേന നിഷ്ക്രിയമാണ്, പക്ഷേ താപനില കൂടുന്നതിനനുസരിച്ച് അതിന്റെ പ്രതിപ്രവർത്തനം വർദ്ധിക്കുന്നു. 1. ലോഹങ്ങൾക്കൊപ്പം സൾഫർ ഓക്സിഡൈസിംഗ് ഗുണങ്ങൾ പ്രദർശിപ്പിക്കുന്നു. ഈ പ്രതിപ്രവർത്തനങ്ങളിൽ സൾഫൈഡുകൾ രൂപം കൊള്ളുന്നു (സ്വർണം, പ്ലാറ്റിനം, ഇറിഡിയം എന്നിവയുമായി പ്രതിപ്രവർത്തിക്കുന്നില്ല): Fe + S \u003d FeS 2. സാധാരണ അവസ്ഥയിൽ, സൾഫർ ഹൈഡ്രജനുമായി പ്രതിപ്രവർത്തിക്കുന്നില്ല, 150-200 at at ന് വിപരീത പ്രതികരണം തുടരുന്നു: 3. ലോഹങ്ങളുമായും ഹൈഡ്രജനുമായുള്ള പ്രതിപ്രവർത്തനങ്ങളിൽ സൾഫർ ഒരു സാധാരണ ഓക്സിഡൈസിംഗ് ഏജന്റായി പ്രവർത്തിക്കുന്നു, ശക്തമായ ഓക്സിഡൈസിംഗ് ഏജന്റുമാരുടെ സാന്നിധ്യത്തിൽ ഇത് സ്വഭാവസവിശേഷതകൾ കുറയ്ക്കുന്നു. S + 3F 2 \u003d SF 6 (അയോഡിനുമായി പ്രതികരിക്കുന്നില്ല) 4. ഓക്സിജനിൽ സൾഫർ കത്തുന്നത് 280 ° at, വായുവിൽ 360 ° at എന്നിങ്ങനെ പോകുന്നു. ഇത് SO 2, SO 3 എന്നിവയുടെ മിശ്രിതമാണ്: S + O 2 \u003d SO 2 2S + 3O 2 \u003d 2SO 3 5. വായു ഇല്ലാതെ ചൂടാക്കുമ്പോൾ സൾഫർ നേരിട്ട് ഫോസ്ഫറസ്, കാർബൺ എന്നിവയുമായി സംയോജിച്ച് ഓക്സിഡൈസിംഗ് ഗുണങ്ങൾ പ്രദർശിപ്പിക്കുന്നു: 2 പി + 3 എസ് \u003d പി 2 എസ് 3 2 എസ് + സി \u003d സിഎസ് 2 6. സങ്കീർണ്ണമായ വസ്തുക്കളുമായി ഇടപഴകുമ്പോൾ, സൾഫർ പ്രധാനമായും കുറയ്ക്കുന്ന ഏജന്റായി പ്രവർത്തിക്കുന്നു:
7. അനുപാതമില്ലാത്ത പ്രതിപ്രവർത്തനങ്ങൾക്ക് സൾഫറിന് കഴിവുണ്ട്. അതിനാൽ, സൾഫർ പൊടി ക്ഷാരങ്ങളോടൊപ്പം തിളപ്പിക്കുമ്പോൾ സൾഫൈറ്റുകളും സൾഫൈഡുകളും രൂപം കൊള്ളുന്നു:
അപ്ലിക്കേഷൻ വ്യവസായത്തിലും കാർഷിക മേഖലയിലും സൾഫർ വ്യാപകമായി ഉപയോഗിക്കുന്നു. ഇതിന്റെ ഉൽപാദനത്തിന്റെ പകുതിയോളം സൾഫ്യൂറിക് ആസിഡിനായി ചെലവഴിക്കുന്നു. റബ്ബറിനെ വൾക്കനൈസ് ചെയ്യാൻ സൾഫർ ഉപയോഗിക്കുന്നു: റബ്ബറിനെ റബ്ബറാക്കി മാറ്റുന്നു. സൾഫർ നിറത്തിന്റെ (നേർത്ത പൊടി) രൂപത്തിൽ, മുന്തിരിത്തോട്ടത്തിന്റെയും പരുത്തിയുടെയും രോഗങ്ങളെ പ്രതിരോധിക്കാൻ സൾഫർ ഉപയോഗിക്കുന്നു. വെടിമരുന്ന്, പൊരുത്തങ്ങൾ, തിളക്കമുള്ള സംയുക്തങ്ങൾ എന്നിവ നേടാൻ ഇത് ഉപയോഗിക്കുന്നു. വൈദ്യത്തിൽ, ചർമ്മ രോഗങ്ങൾക്ക് ചികിത്സിക്കാൻ സൾഫർ തൈലങ്ങൾ തയ്യാറാക്കുന്നു. 4.2. ഹൈഡ്രജൻ സൾഫൈഡ്, സൾഫൈഡുകൾ, ഹൈഡ്രോസൾഫൈഡുകൾ ജലത്തിന്റെ അനലോഗ് ആണ് ഹൈഡ്രജൻ സൾഫൈഡ്. അദ്ദേഹത്തിന്റെ ഇലക്ട്രോണിക് ഫോർമുല സൾഫർ ആറ്റത്തിന്റെ ബാഹ്യ തലത്തിലുള്ള രണ്ട് പി-ഇലക്ട്രോണുകൾ Н-S-H ബോണ്ടുകളുടെ രൂപീകരണത്തിൽ പങ്കാളികളാണെന്ന് ഇത് കാണിക്കുന്നു. എച്ച് 2 എസ് തന്മാത്രയ്ക്ക് കോണീയ ആകൃതിയുണ്ട്, അതിനാൽ ഇത് ധ്രുവമാണ്. ^ പ്രകൃതിയിൽ ആയിരിക്കുക ഹൈഡ്രജൻ സൾഫൈഡ് പ്രകൃതിയിൽ അഗ്നിപർവ്വത വാതകങ്ങളിലും ചില ധാതു നീരുറവകളിലും കാണപ്പെടുന്നു, ഉദാഹരണത്തിന് പ്യതിഗോർസ്ക്, മാറ്റ്സെസ്റ്റ. വിവിധ മൃഗങ്ങളുടെയും സസ്യ അവശിഷ്ടങ്ങളുടെയും സൾഫർ അടങ്ങിയ ജൈവവസ്തുക്കളുടെ ക്ഷയത്തിലാണ് ഇത് രൂപം കൊള്ളുന്നത്. മലിനജലം, സെസ്പൂളുകൾ, മണ്ണിടിച്ചിൽ എന്നിവയുടെ അസുഖകരമായ ദുർഗന്ധം ഇത് വിശദീകരിക്കുന്നു. നേടുന്നു 1. സൾഫറിനെ ഹൈഡ്രജനുമായി നേരിട്ട് ബന്ധിപ്പിക്കുന്നതിലൂടെ ഹൈഡ്രജൻ സൾഫൈഡ് ലഭിക്കും: 2. എന്നാൽ സാധാരണയായി ഇരുമ്പ് (III) സൾഫൈഡിൽ ഹൈഡ്രോക്ലോറിക് അല്ലെങ്കിൽ സൾഫ്യൂറിക് ആസിഡ് നേർപ്പിക്കുന്നതിലൂടെ ഇത് ലഭിക്കും: 2HCl + FeS \u003d FeCl 2 + H 2 S 2H + + FeS \u003d Fe 2+ + H 2 S ഈ പ്രതികരണം പലപ്പോഴും ഒരു കിപ്പ് ഉപകരണത്തിലാണ് നടത്തുന്നത്. ^ ഭൗതിക സവിശേഷതകൾ സാധാരണ അവസ്ഥയിൽ, ചീഞ്ഞ മുട്ടകളുടെ ശക്തമായ സ്വഭാവമുള്ള നിറമില്ലാത്ത വാതകമാണ് ഹൈഡ്രജൻ സൾഫൈഡ്. വളരെ വിഷാംശം, ശ്വസിക്കുമ്പോൾ, ഹീമോഗ്ലോബിനുമായി ബന്ധിപ്പിക്കുകയും പക്ഷാഘാതത്തിന് കാരണമാവുകയും ചെയ്യുന്നു കോ മാരകമാണ്. ചെറിയ സാന്ദ്രതകളിൽ, അപകടസാധ്യത കുറവാണ്. ഫ്യൂം ഹൂഡുകളിലോ ഹെർമെറ്റിക്കലി സീൽ ചെയ്ത ഉപകരണങ്ങളിലോ ഇത് പ്രവർത്തിക്കേണ്ടത് ആവശ്യമാണ്. ഉത്പാദന സ in കര്യങ്ങളിൽ എച്ച് 2 എസിന്റെ അനുവദനീയമായ ഉള്ളടക്കം 1 ലിറ്റർ വായുവിന് 0.01 മില്ലിഗ്രാം ആണ്. ഹൈഡ്രജൻ സൾഫൈഡ് വെള്ളത്തിൽ താരതമ്യേന ലയിക്കുന്നതാണ് (20 ഡിഗ്രി സെൽഷ്യസിൽ, 2.5 വോളിയം ഹൈഡ്രജൻ സൾഫൈഡ് 1 വോളിയം വെള്ളത്തിൽ ലയിക്കുന്നു). ജലത്തിലെ ഹൈഡ്രജൻ സൾഫൈഡിന്റെ ഒരു പരിഹാരത്തെ ഹൈഡ്രജൻ സൾഫൈഡ് വാട്ടർ അല്ലെങ്കിൽ ഹൈഡ്രജൻ സൾഫൈഡ് ആസിഡ് എന്ന് വിളിക്കുന്നു (ഇത് ദുർബലമായ ആസിഡിന്റെ ഗുണങ്ങളെ കണ്ടെത്തുന്നു). ^ രാസ ഗുണങ്ങൾ 1, ശക്തമായ ചൂടാക്കലിനൊപ്പം, സൾഫറിന്റെയും ഹൈഡ്രജന്റെയും രൂപവത്കരണത്തോടെ ഹൈഡ്രജൻ സൾഫൈഡ് പൂർണ്ണമായും വിഘടിക്കുന്നു. 2. സൾഫർ ഓക്സൈഡും (IV) വെള്ളവും രൂപപ്പെടുന്നതോടെ വാതക ഹൈഡ്രജൻ സൾഫൈഡ് നീല ജ്വാല ഉപയോഗിച്ച് വായുവിൽ കത്തുന്നു: 2H 2 S + 3O 2 \u003d 2SO 2 + 2H 2 O. ഓക്സിജന്റെ അഭാവത്തിൽ സൾഫറും വെള്ളവും രൂപം കൊള്ളുന്നു: 2H 2 S + О 2 \u003d 2S + 2Н 2 O 3. ഹൈഡ്രജൻ സൾഫൈഡ് വളരെ ശക്തമായി കുറയ്ക്കുന്ന ഘടകമാണ്. ഈ പ്രധാനപ്പെട്ട രാസ സ്വത്ത് ഇനിപ്പറയുന്ന രീതിയിൽ വിശദീകരിക്കാം. H 2 S ന്റെ ഒരു പരിഹാരത്തിൽ വായു ഓക്സിജൻ തന്മാത്രകൾക്ക് ഇലക്ട്രോണുകൾ നൽകുന്നത് താരതമ്യേന എളുപ്പമാണ്:
അതേസമയം, അന്തരീക്ഷ ഓക്സിജൻ ഹൈഡ്രജൻ സൾഫൈഡിനെ സൾഫറിലേക്ക് ഓക്സിഡൈസ് ചെയ്യുന്നു, ഇത് ഹൈഡ്രജൻ സൾഫൈഡ് ജലത്തെ മൂടുന്നു: 2H 2 S + O 2 \u003d 2S + 2H 2 O. ജൈവവസ്തുക്കളുടെ ക്ഷയ സമയത്ത് ഹൈഡ്രജൻ സൾഫൈഡ് വളരെ വലിയ അളവിൽ പ്രകൃതിയിൽ അടിഞ്ഞു കൂടുന്നില്ല എന്ന വസ്തുതയും ഇത് വിശദീകരിക്കുന്നു - വായുവിലെ ഓക്സിജൻ അതിനെ സ്വതന്ത്ര സൾഫറാക്കി മാറ്റുന്നു. 4, ഹൈഡ്രജൻ സൾഫൈഡ് ഹാലോജൻ പരിഹാരങ്ങളുമായി ശക്തമായി പ്രതികരിക്കുന്നു, ഉദാഹരണത്തിന്: H 2 S + I 2 \u003d 2HI + S സൾഫർ പുറത്തുവിടുകയും അയോഡിൻ ലായനി മാറുകയും ചെയ്യുന്നു. 5. വിവിധ ഓക്സിഡൈസിംഗ് ഏജന്റുകൾ ഹൈഡ്രജൻ സൾഫൈഡുമായി ശക്തമായി പ്രതികരിക്കുന്നു: നൈട്രിക് ആസിഡിന്റെ പ്രവർത്തനത്തിൽ സ്വതന്ത്ര സൾഫർ രൂപം കൊള്ളുന്നു.
6. ഹൈഡ്രജൻ സൾഫൈഡ് ലായനിയിൽ വിഘടനം മൂലം ആസിഡ് പ്രതികരണമുണ്ട്: H 2 SH + + HS - HS - H + + S -2 സാധാരണയായി ആദ്യ ഘട്ടം നിലനിൽക്കും. ഇത് വളരെ ദുർബലമായ ആസിഡാണ്: കാർബണിക്കിനേക്കാൾ ദുർബലമാണ്, ഇത് സാധാരണയായി സൾഫൈഡുകളിൽ നിന്ന് എച്ച് 2 എസ് മാറ്റിസ്ഥാപിക്കുന്നു. സൾഫൈഡുകളും ഹൈഡ്രോസൾഫൈഡുകളും ഹൈഡ്രജൻ സൾഫൈഡ്, ഒരു ഡൈബാസിക് ആയി, രണ്ട് നിര ലവണങ്ങൾ ഉണ്ടാക്കുന്നു: ഇടത്തരം - സൾഫൈഡുകൾ (Na 2 S); ആസിഡിക് - ഹൈഡ്രോസൾഫൈഡുകൾ (NaHS). ഈ ലവണങ്ങൾ ലഭിക്കും: - ഹൈഡ്രജൻ സൾഫൈഡുമായുള്ള ഹൈഡ്രോക്സൈഡുകളുടെ പ്രതിപ്രവർത്തനത്തിലൂടെ: 2NaOH + H 2 S \u003d Na 2 S + 2H 2 O ലോഹങ്ങളുമായുള്ള സൾഫറിന്റെ നേരിട്ടുള്ള ഇടപെടൽ: എച്ച് 2 എസ് അല്ലെങ്കിൽ ലവണങ്ങൾക്കിടയിലുള്ള ലവണങ്ങളുടെ കൈമാറ്റ പ്രതികരണം: Pb (NO 3) 2 + Na 2 S \u003d PbS + 2NaNO 3 CuSO 4 + H 2 S \u003d CuS + H 2 SO 4 Cu 2+ + H 2 S \u003d CuS + 2H + ഹൈഡ്രോസൾഫൈഡുകൾ മിക്കവാറും വെള്ളത്തിൽ ലയിക്കുന്നവയാണ്. ആൽക്കലി, ആൽക്കലൈൻ എർത്ത് ലോഹങ്ങളുടെ സൾഫൈഡുകളും വെള്ളത്തിൽ ലയിക്കുന്നതും നിറമില്ലാത്തതുമാണ്. ഹെവി ലോഹങ്ങളുടെ സൾഫൈഡുകൾ പ്രായോഗികമായി ലയിക്കാത്തതോ വെള്ളത്തിൽ ചെറുതായി ലയിക്കുന്നതോ ആണ് (FeS, MnS, ZnS); അവയിൽ ചിലത് നേർപ്പിച്ച ആസിഡുകളിൽ (CuS, PbS, HgS) ലയിക്കുന്നില്ല. ദുർബലമായ ആസിഡിന്റെ ലവണങ്ങൾ എന്ന നിലയിൽ ജലീയ ലായനികളിലെ സൾഫൈഡുകൾ ശക്തമായി ജലാംശം ചെയ്യുന്നു. ഉദാഹരണത്തിന്, ആൽക്കലി മെറ്റൽ സൾഫൈഡുകൾ വെള്ളത്തിൽ ലയിക്കുമ്പോൾ ഒരു ക്ഷാര പ്രതിപ്രവർത്തനം ഉണ്ട്: Na 2 S + HOHNaHS + NaOH ഹൈഡ്രജൻ സൾഫൈഡ് പോലെ എല്ലാ സൾഫൈഡുകളും കുറയ്ക്കുന്ന ഏജന്റുകളാണ്: 3PbS -2 + 8HN +5 O 3 (വിഘടിപ്പിക്കുന്നു.) \u003d 3PbS +6 O 4 + 4H 2 O + 8N +2 O
ചില സൾഫൈഡുകൾക്ക് സ്വഭാവഗുണമുണ്ട്: CuS, PbS - കറുപ്പ്, സിഡിഎസ് - മഞ്ഞ, ZnS - വെള്ള, MnS - പിങ്ക്, SnS - തവിട്ട്, അൽ 2 S 3 - ഓറഞ്ച്. സൾഫൈഡുകളുടെ വ്യത്യസ്ത ലായകതയെയും അവയിൽ പലതിന്റെയും വ്യത്യസ്ത നിറങ്ങളെയും അടിസ്ഥാനമാക്കിയുള്ളതാണ് കാറ്റേഷനുകളുടെ ഗുണപരമായ വിശകലനം. ^ 4.3. സൾഫർ ഓക്സൈഡ് (IV), സൾഫ്യൂറിക് ആസിഡ് സൾഫർ ഓക്സൈഡ് (IV) അഥവാ സൾഫറസ് വാതകം സാധാരണ അവസ്ഥയിൽ നിറമില്ലാത്ത വാതകമാണ്. -10 ° C വരെ തണുപ്പിക്കുമ്പോൾ, അത് നിറമില്ലാത്ത ദ്രാവകമായി ദ്രവീകരിക്കുന്നു. നേടുന്നു 1. ലബോറട്ടറി സാഹചര്യങ്ങളിൽ, സൾഫർ ഡയോക്സൈഡ് (IV) സൾഫ്യൂറസ് ആസിഡിന്റെ ലവണങ്ങളിൽ നിന്ന് ശക്തമായ ആസിഡുകളുടെ പ്രവർത്തനം വഴി ലഭിക്കും: Na 2 SO 3 + H 2 SO 4 \u003d Na 2 SO 4 + S0 2 + H 2 O 2NaHSO 3 + H 2 SO 4 \u003d Na 2 SO 4 + 2SO 2 + 2H 2 O 2HSO - 3 + 2H + \u003d 2SO 2 + 2H 2 O. 2. നിഷ്ക്രിയ ലോഹങ്ങളുമായി ചൂടാക്കുമ്പോൾ സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡിന്റെ പ്രതിപ്രവർത്തനത്തിലൂടെയും സൾഫർ വാതകം രൂപം കൊള്ളുന്നു: Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2Н 2 Cu + 4H + + 2SO 2-4 \u003d Cu 2+ + SO 2-4 + SO 2 + 2H 2 O 3. സൾഫർ വായുവിലോ ഓക്സിജനിലോ കത്തിക്കുമ്പോൾ സൾഫർ ഓക്സൈഡ് (IV) രൂപം കൊള്ളുന്നു: 4. വ്യാവസായിക സാഹചര്യങ്ങളിൽ, പൈറൈറ്റ് FeS 2 അല്ലെങ്കിൽ നോൺ-ഫെറസ് ലോഹങ്ങളുടെ സൾഫ്യൂസ് അയിരുകൾ (സിങ്ക് ബ്ലെൻഡെ ZnS, ലെഡ് ഗ്ലോസ് PbS മുതലായവ) കണക്കാക്കിയാണ് SO 2 ലഭിക്കുന്നത്: 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2 SO 2 എന്ന തന്മാത്രയുടെ ഘടനാപരമായ സൂത്രവാക്യം: SO 2 തന്മാത്രയിലെ ബോണ്ടുകളുടെ രൂപീകരണത്തിൽ നാല് സൾഫർ ഇലക്ട്രോണുകളും രണ്ട് ഓക്സിജൻ ആറ്റങ്ങളിൽ നിന്നുള്ള നാല് ഇലക്ട്രോണുകളും പങ്കെടുക്കുന്നു. ബന്ധിപ്പിക്കുന്ന ഇലക്ട്രോൺ ജോഡികളുടെ പരസ്പര വിരോധവും പങ്കിടാത്ത ഇലക്ട്രോൺ ജോഡി സൾഫറും തന്മാത്രയ്ക്ക് കോണാകൃതി നൽകുന്നു. രാസ ഗുണങ്ങൾ 1. സൾഫർ ഓക്സൈഡ് (IV) ആസിഡ് ഓക്സൈഡുകളുടെ എല്ലാ ഗുണങ്ങളും പ്രദർശിപ്പിക്കുന്നു: ജലവുമായുള്ള ഇടപെടൽ, ക്ഷാര ഇടപെടൽ, അടിസ്ഥാന ഓക്സൈഡുകളുമായുള്ള ഇടപെടൽ. 2. സൾഫർ (IV) ഓക്സൈഡിന്റെ സവിശേഷതകൾ കുറയ്ക്കുന്ന സ്വഭാവമാണ്: S +4 O 2 + O 0 2 2S +6 O -2 3 (ചൂടാക്കുമ്പോൾ ഒരു കാറ്റലിസ്റ്റിന്റെ സാന്നിധ്യത്തിൽ)
എന്നാൽ ശക്തമായ കുറയ്ക്കുന്ന ഏജന്റുകളുടെ സാന്നിധ്യത്തിൽ, SO 2 ഒരു ഓക്സിഡൈസിംഗ് ഏജന്റായി പ്രവർത്തിക്കുന്നു:
സൾഫറിന് +4 ഓക്\u200cസിഡേഷൻ അവസ്ഥയുണ്ടെന്ന വസ്തുത സൾഫർ ഓക്സൈഡിന്റെ (IV) റെഡോക്സ് ദ്വൈതത വിശദീകരിക്കുന്നു, അതിനാൽ 2 ഇലക്ട്രോണുകൾ നൽകി S +6 ലേക്ക് ഓക്സീകരിക്കാനും 4 ഇലക്ട്രോണുകൾ എടുക്കുന്നതിലൂടെ ഇത് S to ആയി കുറയ്ക്കാനും കഴിയും. ഇവയുടെയോ മറ്റ് ഗുണങ്ങളുടെയോ പ്രകടനം പ്രതിപ്രവർത്തിക്കുന്ന ഘടകത്തിന്റെ സ്വഭാവത്തെ ആശ്രയിച്ചിരിക്കുന്നു. സൾഫർ ഓക്സൈഡ് (IV) വെള്ളത്തിൽ എളുപ്പത്തിൽ ലയിക്കുന്നു (SO 2 ന്റെ 40 വോള്യങ്ങൾ 1 വോള്യത്തിൽ 20 ° C ന് അലിഞ്ഞുചേരുന്നു). ഈ സാഹചര്യത്തിൽ, ജലീയ ലായനിയിൽ മാത്രം നിലനിൽക്കുന്ന സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു: SO 2 + H 2 ОH 2 SO 3 പ്രതികരണം പഴയപടിയാക്കാനാകും. ജലീയ ലായനിയിൽ, സൾഫർ (IV) ഓക്സൈഡും സൾഫർ ഡയോക്സൈഡും രാസ സന്തുലിതാവസ്ഥയിലാണ്, അത് സ്ഥാനഭ്രംശം സംഭവിക്കാം. H 2 SO 3 ബന്ധിപ്പിക്കുമ്പോൾ (ആസിഡിന്റെ ന്യൂട്രലൈസേഷൻ നിങ്ങൾ) പ്രതികരണം സൾഫറസ് ആസിഡിന്റെ രൂപവത്കരണത്തിലേക്ക് നീങ്ങുന്നു; SO 2 നീക്കംചെയ്യുമ്പോൾ (ഒരു നൈട്രജൻ ലായനിയിലൂടെയോ ചൂടാക്കലിലൂടെയോ ശുദ്ധീകരിക്കുന്നു), പ്രതികരണം ആരംഭിക്കുന്ന വസ്തുക്കളുടെ ദിശയിലേക്ക് പോകുന്നു. സൾഫ്യൂറിക് ആസിഡിൽ എല്ലായ്പ്പോഴും സൾഫർ (IV) ഓക്സൈഡ് അടങ്ങിയിട്ടുണ്ട്, ഇത് ഒരു ദുർഗന്ധം നൽകുന്നു. സൾഫ്യൂറിക് ആസിഡിന് ആസിഡുകളുടെ എല്ലാ ഗുണങ്ങളും ഉണ്ട്. പരിഹാരത്തിൽ, ഇത് പടിപടിയായി വേർതിരിക്കുന്നു: H 2 SO 3 Н + + HSO - 3 HSO - 3 Н + + SO 2- 3 താപ അസ്ഥിരവും അസ്ഥിരവുമാണ്. സൾഫ്യൂറിക് ആസിഡ് ഒരു ഡിബാസിക് ആയി രണ്ട് തരം ലവണങ്ങൾ ഉണ്ടാക്കുന്നു: ഇടത്തരം - സൾഫൈറ്റുകൾ (Na 2 SO 3); ആസിഡിക് - ഹൈഡ്രോസൾഫൈറ്റുകൾ (NaHSO 3). ക്ഷാരവുമായി ആസിഡ് പൂർണ്ണമായും നിർവീര്യമാക്കുമ്പോൾ സൾഫൈറ്റുകൾ രൂപം കൊള്ളുന്നു: H 2 SO 3 + 2NaOH \u003d Na 2 SO 3 + 2H 2 O. ക്ഷാരത്തിന്റെ അഭാവത്തോടെയാണ് ഹൈഡ്രോസൾഫൈറ്റുകൾ ലഭിക്കുന്നത്: H 2 SO 3 + NaOH \u003d NaHSO 3 + H 2 O. സൾഫ്യൂറിക് ആസിഡിനും അതിന്റെ ലവണങ്ങൾക്കും ഓക്സിഡൈസ് ചെയ്യുന്നതിനും കുറയ്ക്കുന്നതിനുമുള്ള സ്വഭാവങ്ങളുണ്ട്, ഇത് പ്രതികരണ പങ്കാളിയുടെ സ്വഭാവമനുസരിച്ച് നിർണ്ണയിക്കപ്പെടുന്നു. 1. അതിനാൽ, ഓക്സിജന്റെ സ്വാധീനത്തിൽ സൾഫൈറ്റുകൾ സൾഫേറ്റുകളിലേക്ക് ഓക്സീകരിക്കപ്പെടുന്നു: 2Na 2 S +4 O 3 + O 0 2 \u003d 2Na 2 S +6 O -2 4
ബ്രോമിൻ, പൊട്ടാസ്യം പെർമാങ്കനേറ്റ് എന്നിവ സൾഫ്യൂറിക് ആസിഡിന്റെ ഓക്സീകരണം കൂടുതൽ എളുപ്പമാക്കുന്നു:
5H 2 S +4 O 3 + 2KMn +7 O 4 \u003d 2H 2 S +6 O 4 + 2Mn +2 S +6 O 4 + K 2 S +6 O 4 + 3H 2 O
2. കൂടുതൽ get ർജ്ജസ്വലമായ കുറയ്ക്കുന്ന ഏജന്റുകളുടെ സാന്നിധ്യത്തിൽ, സൾഫൈറ്റുകൾ ഓക്സിഡൈസിംഗ് ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു:
മിക്കവാറും എല്ലാ ഹൈഡ്രോസൾഫൈറ്റുകളും ക്ഷാര ലോഹ സൾഫൈറ്റുകളും സൾഫ്യൂറിക് ആസിഡ് ലവണങ്ങളിൽ നിന്ന് അലിഞ്ഞു പോകുന്നു. 3. എച്ച് 2 എസ്ഒ 3 ഒരു ദുർബല ആസിഡ് ആയതിനാൽ, സൾഫൈറ്റുകളിലും ഹൈഡ്രോസൾഫൈറ്റുകളിലും ആസിഡുകളുടെ പ്രവർത്തനത്തിലാണ് എസ്ഒ 2 പുറത്തുവിടുന്നത്. SO 2 ന്റെ നിർമ്മാണത്തിൽ ഈ രീതി സാധാരണയായി ഉപയോഗിക്കുന്നു. ലബോറട്ടറി അവസ്ഥയിൽ: NaHSO 3 + H 2 SO 4 \u003d Na 2 SO 4 + SO 2 + H 2 O. 4. വെള്ളത്തിൽ ലയിക്കുന്ന സൾഫൈറ്റുകൾ പെട്ടെന്ന് ജലവിശ്ലേഷണത്തിന് വിധേയമാകുന്നു, അതിന്റെ ഫലമായി ലായനിയിലെ OH - അയോണുകളുടെ സാന്ദ്രത വർദ്ധിക്കുന്നു: Na 2 SO 3 + HOHNaHSO 3 + NaOH അപ്ലിക്കേഷൻ സൾഫർ ഓക്സൈഡും (IV) സൾഫ്യൂറസ് ആസിഡും ധാരാളം ചായങ്ങൾ വിച്ഛേദിക്കുകയും അവയ്ക്കൊപ്പം നിറമില്ലാത്ത സംയുക്തങ്ങൾ രൂപപ്പെടുകയും ചെയ്യുന്നു. രണ്ടാമത്തേത് ചൂടാക്കുമ്പോഴോ വെളിച്ചത്തിലോ വീണ്ടും വിഘടിപ്പിക്കുന്നു, അതിന്റെ ഫലമായി നിറം പുന .സ്ഥാപിക്കപ്പെടുന്നു. അതിനാൽ, SO 2, H 2 SO 3 എന്നിവയുടെ വെളുപ്പിക്കൽ പ്രവർത്തനം ക്ലോറിൻ വെളുപ്പിക്കുന്നതിനുള്ള പ്രവർത്തനത്തിൽ നിന്ന് വ്യത്യസ്തമാണ്. കമ്പിളി, പട്ട്, വൈക്കോൽ എന്നിവ വെളുപ്പിക്കാൻ സാധാരണയായി സൾഫർ (IV) rxide ഉപയോഗിക്കുന്നു. സൾഫർ ഓക്സൈഡ് (IV) നിരവധി സൂക്ഷ്മാണുക്കളെ കൊല്ലുന്നു. അതിനാൽ, പൂപ്പൽ നശിപ്പിക്കുന്നതിന്, അസംസ്കൃത നിലവറകൾ, നിലവറകൾ, വൈൻ ബാരലുകൾ മുതലായവ ഉപയോഗിച്ച് അവയെ ധരിപ്പിക്കുന്നു. പഴങ്ങളുടെയും സരസഫലങ്ങളുടെയും ഗതാഗതത്തിലും സംഭരണത്തിലും ഇത് ഉപയോഗിക്കുന്നു. വലിയ അളവിൽ സൾഫ്യൂറിക് ആസിഡ് ഉത്പാദിപ്പിക്കാൻ സൾഫർ ഓക്സൈഡ് IV ഉപയോഗിക്കുന്നു. മരവും പേപ്പർ പൾപ്പും പ്രോസസ്സ് ചെയ്യുന്ന കാൽസ്യം ഹൈഡ്രോസൾഫൈറ്റ് CaHSO 3 (സൾഫൈറ്റ് മദ്യം) ഒരു പരിഹാരമാണ് ഒരു പ്രധാന ആപ്ലിക്കേഷൻ. ^ 4.4. സൾഫർ ഓക്സൈഡ് (VI). സൾഫ്യൂറിക് ആസിഡ് സൾഫർ ഓക്സൈഡ് (VI) (പട്ടിക 20 കാണുക) 16.8 ° C താപനിലയിൽ ഖര സ്ഫടിക പിണ്ഡത്തിലേക്ക് ഉറപ്പിക്കുന്ന നിറമില്ലാത്ത ദ്രാവകമാണ്. ഇത് ഈർപ്പം വളരെ ശക്തമായി ആഗിരണം ചെയ്യുകയും സൾഫ്യൂറിക് ആസിഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു: SO 3 + H 2 O \u003d H 2 SO 4 പട്ടിക 20. സൾഫർ ഓക്സൈഡുകളുടെ സവിശേഷതകൾ
സൾഫർ (ആറാമത്) ഓക്സൈഡുകൾ വെള്ളത്തിൽ ലയിക്കുന്നതിനൊപ്പം ഗണ്യമായ അളവിൽ താപം പുറപ്പെടുവിക്കുന്നു. സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡിൽ സൾഫർ ഓക്സൈഡ് (VI) വളരെ ലയിക്കുന്നതാണ്. അൺ\u200cഹൈഡ്രസ് ആസിഡിലെ SO 3 ന്റെ പരിഹാരത്തെ ഓലിയം എന്ന് വിളിക്കുന്നു. ഓലിയങ്ങളിൽ 70% SO 3 വരെ അടങ്ങിയിരിക്കാം. നേടുന്നു 1. 450 ° C താപനിലയിൽ കാറ്റലിസ്റ്റുകളുടെ സാന്നിധ്യത്തിൽ ഓക്സിജൻ സൾഫർ ഡയോക്സൈഡ് ഓക്സീകരിക്കപ്പെടുന്നതിലൂടെ സൾഫർ ഓക്സൈഡ് (VI) ലഭിക്കും (കാണുക സൾഫ്യൂറിക് ആസിഡ് ലഭിക്കുന്നു): 2SO 2 + O 2 \u003d 2SO 3 2. SO 2 മുതൽ SO 3 വരെ ഓക്സിഡൈസ് ചെയ്യുന്നതിനുള്ള മറ്റൊരു മാർഗ്ഗം നൈട്രിക് ഓക്സൈഡ് (IV) ഓക്സിഡൈസിംഗ് ഏജന്റായി ഉപയോഗിക്കുക എന്നതാണ്:
തത്ഫലമായുണ്ടാകുന്ന നൈട്രിക് ഓക്സൈഡ് (II) ഓക്സിജനുമായി പ്രതിപ്രവർത്തിക്കുമ്പോൾ എളുപ്പത്തിലും വേഗത്തിലും നൈട്രിക് ഓക്സൈഡ് (IV) ആയി മാറുന്നു: 2NO + О 2 \u003d 2NO 2 ഇത് SO 2 ന്റെ ഓക്സീകരണത്തിൽ വീണ്ടും ഉപയോഗിക്കാൻ കഴിയും. തൽഫലമായി, NO 2 ഒരു ഓക്സിജൻ കാരിയറായി പ്രവർത്തിക്കുന്നു. SO 2 മുതൽ SO 3 വരെ ഓക്സിഡൈസ് ചെയ്യുന്ന ഈ രീതിയെ നൈട്രസ് എന്ന് വിളിക്കുന്നു. SO 3 തന്മാത്രയ്ക്ക് ഒരു ത്രികോണത്തിന്റെ ആകൃതിയുണ്ട്, അതിന്റെ മധ്യഭാഗത്ത് സൾഫർ ആറ്റം സ്ഥിതിചെയ്യുന്നു: ബന്ധിപ്പിക്കുന്ന ഇലക്ട്രോൺ ജോഡികളുടെ പരസ്പര വിരോധമാണ് ഈ ഘടനയ്ക്ക് കാരണം. സൾഫർ ആറ്റം അവയുടെ രൂപീകരണത്തിന് ആറ് ബാഹ്യ ഇലക്ട്രോണുകൾ നൽകി. രാസ ഗുണങ്ങൾ 1. SO 3 ഒരു സാധാരണ ആസിഡ് ഓക്സൈഡാണ്. 2. സൾഫർ ഓക്സൈഡിന് (VI) ശക്തമായ ഓക്സിഡൈസിംഗ് ഏജന്റിന്റെ ഗുണങ്ങളുണ്ട്. അപ്ലിക്കേഷൻ സൾഫ്യൂറിക് ആസിഡ് ഉത്പാദിപ്പിക്കാൻ സൾഫർ ഓക്സൈഡ് (VI) ഉപയോഗിക്കുന്നു. നേടുന്നതിനുള്ള കോൺ\u200cടാക്റ്റ് രീതിയാണ് ഏറ്റവും പ്രധാനം സൾഫ്യൂറിക് ആസിഡ്. ഈ രീതിയിലൂടെ, ഏതെങ്കിലും സാന്ദ്രതയുടെ H 2 SO 4, അതുപോലെ ഓലിയം എന്നിവ നേടാൻ കഴിയും. പ്രക്രിയയിൽ മൂന്ന് ഘട്ടങ്ങളുണ്ട്: എസ്ഒ 2 നേടുക; SO 2 മുതൽ SO 3 വരെ ഓക്സീകരണം; H 2 SO 4 നേടുന്നു. പ്രത്യേക ചൂളകളിൽ പൈറൈറ്റ് FeS 2 കത്തിച്ചാണ് SO 2 ലഭിക്കുന്നത്: 4FeS 2 + 11О 2 \u003d 2Fe 2 O 3 + 8SO 2 ഫയറിംഗ് ത്വരിതപ്പെടുത്തുന്നതിന്, പൈറൈറ്റ് പ്രീ-ക്രഷ്ഡ് ആണ്, കൂടാതെ സൾഫറിൽ നിന്ന് പൂർണ്ണമായി കത്തുന്നതിനായി, പ്രതിപ്രവർത്തനത്തിന് ആവശ്യമുള്ളതിനേക്കാൾ കൂടുതൽ വായു (ഓക്സിജൻ) അവതരിപ്പിക്കപ്പെടുന്നു. ചൂളയിൽ നിന്ന് പുറപ്പെടുന്ന വാതകത്തിൽ സൾഫർ ഓക്സൈഡ് (IV), ഓക്സിജൻ, നൈട്രജൻ, ആർസെനിക് സംയുക്തങ്ങൾ (പൈറൈറ്റുകളിലെ മാലിന്യങ്ങളിൽ നിന്ന്), നീരാവി എന്നിവ അടങ്ങിയിരിക്കുന്നു. ഇതിനെ കത്തുന്ന വാതകം എന്ന് വിളിക്കുന്നു. ഫയറിംഗ് വാതകം നന്നായി വൃത്തിയാക്കുന്നു, കാരണം ആർസെനിക് സംയുക്തങ്ങളുടെ ഒരു ചെറിയ ഉള്ളടക്കവും പൊടിയും ഈർപ്പവും പോലും ഉത്തേജകത്തെ വിഷലിപ്തമാക്കുന്നു. ആർസെനിക് സംയുക്തങ്ങളിൽ നിന്നും പൊടിയിൽ നിന്നും പ്രത്യേക ഇലക്ട്രോ ഫിൽട്ടറുകളിലൂടെയും വാഷിംഗ് ടവറിലൂടെയും വാതകം ശുദ്ധീകരിക്കപ്പെടുന്നു; ഉണങ്ങിയ ടവറിൽ സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ഈർപ്പം ആഗിരണം ചെയ്യും. ഓക്സിജൻ അടങ്ങിയ ശുദ്ധീകരിച്ച വാതകം ചൂട് എക്സ്ചേഞ്ചറിൽ 450 ° C വരെ ചൂടാക്കുകയും കോൺടാക്റ്റ് ഉപകരണത്തിലേക്ക് പ്രവേശിക്കുകയും ചെയ്യുന്നു. കോൺടാക്റ്റ് ഉപകരണത്തിനുള്ളിൽ കാറ്റലിസ്റ്റ് നിറച്ച ലാറ്റിസ് അലമാരകളുണ്ട്. മുമ്പ്, നന്നായി വിഭജിച്ച മെറ്റൽ പ്ലാറ്റിനം ഒരു ഉത്തേജകമായി ഉപയോഗിച്ചിരുന്നു. തുടർന്ന്, വനേഡിയം സംയുക്തങ്ങൾ - വനേഡിയം (വി) ഓക്സൈഡ് വി 2 ഒ 5 അല്ലെങ്കിൽ വനാഡൈൽ സൾഫേറ്റ് വോസോ 4 എന്നിവ മാറ്റിസ്ഥാപിച്ചു, അവ പ്ലാറ്റിനത്തേക്കാൾ വിലകുറഞ്ഞതും സാവധാനത്തിൽ വിഷം കലർന്നതുമാണ്. SO 2 മുതൽ SO 3 വരെയുള്ള ഓക്സീകരണ പ്രതിപ്രവർത്തനം പഴയപടിയാക്കാനാകും: 2SO 2 + O 2 2SO 3 കാൽ\u200cസൈനിംഗ് വാതകത്തിലെ ഓക്സിജന്റെ അളവ് വർദ്ധിക്കുന്നത് സൾഫർ ഓക്സൈഡിന്റെ (VI) വിളവ് വർദ്ധിപ്പിക്കുന്നു: 450 ° C താപനിലയിൽ ഇത് സാധാരണയായി 95% ഉം അതിലും ഉയർന്നതുമാണ്. തത്ഫലമായുണ്ടാകുന്ന സൾഫർ ഓക്സൈഡ് (VI) പിന്നീട് ഒരു ആഗിരണം ടവറിന് വിപരീതമായി നൽകുന്നു, അവിടെ ഇത് സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ആഗിരണം ചെയ്യുന്നു. ഇത് പൂരിതമാകുമ്പോൾ, ആദ്യം ഹൈഡ്രജൻ സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു, തുടർന്ന് ഓലിയം. തുടർന്ന്, ഓലിയം 98% സൾഫ്യൂറിക് ആസിഡിലേക്ക് ലയിപ്പിച്ച് ഉപയോക്താക്കൾക്ക് വിതരണം ചെയ്യുന്നു. സൾഫ്യൂറിക് ആസിഡിന്റെ ഘടനാപരമായ സൂത്രവാക്യം:
^ ഭൗതിക സവിശേഷതകൾ കനത്തതും നിറമില്ലാത്തതും എണ്ണമയമുള്ളതുമായ ദ്രാവകമാണ് സൾഫ്യൂറിക് ആസിഡ്, ഇത് + 10.4 at C ൽ ക്രിസ്റ്റലൈസ് ചെയ്യുന്നു, ഏകദേശം രണ്ടുതവണ ( \u003d 1.83 ഗ്രാം / സെ.മീ 3) വെള്ളത്തേക്കാൾ ഭാരം, ദുർഗന്ധം, അസ്ഥിരമല്ലാത്തത്. അങ്ങേയറ്റം ഭീമാകാരമായ. ഒരു വലിയ അളവിലുള്ള താപം പുറത്തുവിടുന്നതിലൂടെ ഇത് ഈർപ്പം ആഗിരണം ചെയ്യും, അതിനാൽ നിങ്ങൾക്ക് സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡിലേക്ക് വെള്ളം ഒഴിക്കാൻ കഴിയില്ല - ആസിഡ് തെറിക്കും. ഒരിക്കൽ കൂട്ടിച്ചേർക്കലുകൾ സൾഫ്യൂറിക് ആസിഡ് ചെറിയ ഭാഗങ്ങളിൽ വെള്ളത്തിൽ ചേർക്കണം. അൺഹൈഡ്രസ് സൾഫ്യൂറിക് ആസിഡ് സൾഫർ ഓക്സൈഡിന്റെ (VI) 70% വരെ ലയിക്കുന്നു. ചൂടാക്കുമ്പോൾ, 98.3% ന്റെ H 2 SO 4 ന്റെ പിണ്ഡം ഉപയോഗിച്ച് ഒരു പരിഹാരം ഉണ്ടാകുന്നതുവരെ SO 3 വേർപെടുത്തുക. അൺ\u200cഹൈഡ്രസ് എച്ച് 2 എസ്\u200cഒ 4 മിക്കവാറും വൈദ്യുത പ്രവാഹം നടത്തുന്നില്ല. ^ രാസ ഗുണങ്ങൾ 1. ഇത് ഏതെങ്കിലും അനുപാതത്തിൽ വെള്ളവുമായി കലർന്ന് വിവിധ കോമ്പോസിഷനുകളുടെ ഹൈഡ്രേറ്റുകൾ ഉണ്ടാക്കുന്നു: H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6.5H 2 O 2. സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ജൈവവസ്തുക്കളെ കാർബണൈസ് ചെയ്യുന്നു - പഞ്ചസാര, കടലാസ്, മരം, നാരുകൾ, അവയിൽ നിന്ന് ജല ഘടകങ്ങളെ അകറ്റുന്നു: C 12 H 22 O 11 + H 2 SO 4 \u003d 12 C + H 2 SO 4 11 H 2 O. തത്ഫലമായുണ്ടാകുന്ന കൽക്കരി ഭാഗികമായി ആസിഡുമായി പ്രതിപ്രവർത്തിക്കുന്നു:
സൾഫ്യൂറിക് ആസിഡ് വെള്ളം ആഗിരണം ചെയ്യുന്നതിനെ അടിസ്ഥാനമാക്കിയുള്ളതാണ് വാതക ആഗിരണം. വരണ്ട ലവണങ്ങളിൽ നിന്ന് മറ്റ് ആസിഡുകളെ എച്ച് 2 എസ്ഒ 4 സ്ഥാനചലനം ചെയ്യുന്നത് എത്ര ശക്തമാണ്: NaNO 3 + H 2 SO 4 \u003d NaHSO 4 + HNO 3 എന്നിരുന്നാലും, ഉപ്പ് ലായനിയിൽ H 2 SO 4 ചേർത്താൽ, ആസിഡ് സ്ഥാനചലനം സംഭവിക്കുന്നില്ല. H 2 SO 4 - ശക്തമായ ഡിബാസിക് ആസിഡ്: H 2 SO 4 Н + + HSO - 4 HSO - 4 H + + SO 2-4 അസ്ഥിരമല്ലാത്ത ശക്തമായ ആസിഡുകളുടെ എല്ലാ ഗുണങ്ങളും ഇതിന് ഉണ്ട്. നേർപ്പിച്ച സൾഫ്യൂറിക് ആസിഡ് ഓക്സിഡൈസ് ചെയ്യാത്ത ആസിഡുകളുടെ എല്ലാ ഗുണങ്ങളും സ്വഭാവ സവിശേഷതയാണ്. അതായത്: ഇത് ലോഹങ്ങളുമായി സംവദിക്കുന്നു, അവ ഹൈഡ്രജനുമായുള്ള ലോഹ സമ്മർദ്ദങ്ങളുടെ ഇലക്ട്രോകെമിക്കൽ ശ്രേണിയിലാണ്:
ലോഹങ്ങളുമായുള്ള പ്രതിപ്രവർത്തനം ഹൈഡ്രജൻ അയോണുകളുടെ കുറവാണ്. 6. സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ഒരു get ർജ്ജമേറിയ ഓക്സിഡൈസിംഗ് ഏജന്റാണ്. ചൂടാക്കുമ്പോൾ, ഹൈഡ്രജന് ശേഷമുള്ള ഇലക്ട്രോകെമിക്കൽ സീരീസ് വോൾട്ടേജുകളുൾപ്പെടെ മിക്ക ലോഹങ്ങളെയും ഇത് ഓക്സിഡൈസ് ചെയ്യുന്നു.അത് പ്ലാറ്റിനം, സ്വർണ്ണം എന്നിവയുമായി മാത്രം പ്രതികരിക്കുന്നില്ല. ലോഹത്തിന്റെ പ്രവർത്തനത്തെ ആശ്രയിച്ച്, എസ് -2, എസ് °, എസ് +4 എന്നിവ റിഡക്ഷൻ ഉൽപ്പന്നങ്ങളായി ഉപയോഗിക്കാം.
തണുത്ത കാലാവസ്ഥയിൽ, സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് അലുമിനിയം, ഇരുമ്പ്, ക്രോമിയം പോലുള്ള ശക്തമായ ലോഹങ്ങളുമായി പ്രതിപ്രവർത്തിക്കുന്നില്ല. ലോഹങ്ങളുടെ നിഷ്ക്രിയത്വമാണ് ഇതിന് കാരണം. ഇരുമ്പ് പാത്രങ്ങളിലെ ഗതാഗതത്തിനായി ഈ സവിശേഷത വ്യാപകമായി ഉപയോഗിക്കുന്നു. എന്നിരുന്നാലും, ചൂടാക്കുമ്പോൾ:
അങ്ങനെ, ആസിഡ് രൂപപ്പെടുന്ന ആറ്റങ്ങളുടെ കുറവ് കാരണം സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് ലോഹങ്ങളുമായി സംവദിക്കുന്നു. വെള്ളത്തിലും ആസിഡുകളിലും ലയിക്കാത്ത വെളുത്ത ക്രിസ്റ്റലിൻ പ്രിസിപിറ്റേറ്റ് ബാസോ 4 ന്റെ രൂപവത്കരണമാണ് സൾഫേറ്റ് അയോൺ എസ്ഒ 2-4 ന്റെ ഗുണപരമായ പ്രതികരണം: SO 2- 4 + Ba +2 aBaSO 4 അപ്ലിക്കേഷൻ നോൺ-ഉൽപാദനത്തിൽ ഏർപ്പെട്ടിരിക്കുന്ന പ്രധാന രാസ വ്യവസായത്തിന്റെ അവശ്യ ഉൽ\u200cപന്നമാണ് സൾഫ്യൂറിക് ആസിഡ് ജൈവ ആസിഡുകൾ, ക്ഷാരങ്ങൾ, ലവണങ്ങൾ, ധാതു വളങ്ങൾ, ക്ലോറിൻ. വിവിധതരം ആപ്ലിക്കേഷനുകൾ അനുസരിച്ച്, സൾഫ്യൂറിക് ആസിഡ് ആസിഡുകളിൽ ഒന്നാം സ്ഥാനത്താണ്. ഫോസ്ഫറസും നൈട്രജൻ വളങ്ങളും ഉത്പാദിപ്പിക്കാൻ ഇതിന്റെ ഏറ്റവും വലിയ അളവ് ഉപയോഗിക്കുന്നു. അസ്ഥിരമല്ലാത്തതിനാൽ സൾഫ്യൂറിക് ആസിഡ് മറ്റ് ആസിഡുകൾ ഉൽ\u200cപാദിപ്പിക്കാൻ ഉപയോഗിക്കുന്നു - ഹൈഡ്രോക്ലോറിക്, ഹൈഡ്രജൻ ഫ്ലൂറൈഡ്, ഫോസ്ഫോറിക്, അസറ്റിക്. ദോഷകരമായ മാലിന്യങ്ങളിൽ നിന്ന് എണ്ണ ഉൽ\u200cപന്നങ്ങൾ - ഗ്യാസോലിൻ, മണ്ണെണ്ണ, ലൂബ്രിക്കറ്റിംഗ് ഓയിൽ എന്നിവ വൃത്തിയാക്കുന്നതിന് ഇത് ധാരാളം പോകുന്നു. മെക്കാനിക്കൽ എഞ്ചിനീയറിംഗിൽ, സൾഫ്യൂറിക് ആസിഡ് പൂശുന്നതിന് മുമ്പ് ഓക്സൈഡുകളിൽ നിന്ന് ലോഹത്തിന്റെ ഉപരിതലം വൃത്തിയാക്കുന്നു (നിക്കൽ പ്ലേറ്റിംഗ്, ക്രോമിയം പ്ലേറ്റിംഗ് മുതലായവ). സ്ഫോടകവസ്തുക്കൾ, കൃത്രിമ നാരുകൾ, ചായങ്ങൾ, പ്ലാസ്റ്റിക് എന്നിവ നിർമ്മിക്കാൻ സൾഫ്യൂറിക് ആസിഡ് ഉപയോഗിക്കുന്നു. ബാറ്ററികൾ പൂരിപ്പിക്കുന്നതിന് ഇത് ഉപയോഗിക്കുന്നു. സൾഫ്യൂറിക് ആസിഡ് ലവണങ്ങൾ പ്രധാനമാണ്. Od സോഡിയം സൾഫേറ്റ്Na 2 SO 4 ജലീയ ലായനികളിൽ നിന്ന് Na 2 SO 4 10H 2 O ന്റെ ഹൈഡ്രേറ്റ് രൂപത്തിൽ ക്രിസ്റ്റലൈസ് ചെയ്യുന്നു, ഇതിനെ ഗ്ലോബർ ഉപ്പ് എന്ന് വിളിക്കുന്നു. ഇത് ഒരു പോഷകസമ്പുഷ്ടമായി വൈദ്യത്തിൽ ഉപയോഗിക്കുന്നു. സോഡയുടെയും ഗ്ലാസിന്റെയും ഉൽപാദനത്തിൽ അൺഹൈഡ്രസ് സോഡിയം സൾഫേറ്റ് ഉപയോഗിക്കുന്നു. ^ അമോണിയം സൾഫേറ്റ്(NH 4) 2 SO 4 - നൈട്രജൻ വളം. പൊട്ടാസ്യം സൾഫേറ്റ്K 2 SO 4 - പൊട്ടാഷ് വളം. കാൽസ്യം സൾഫേറ്റ് CaSO 4 പ്രകൃതിയിൽ ജിപ്\u200cസം ധാതു രൂപത്തിൽ കാണപ്പെടുന്നു CaSO 4 2H 2 O. 150 ° C വരെ ചൂടാക്കുമ്പോൾ, അത് ജലത്തിന്റെ ഒരു ഭാഗം നഷ്ടപ്പെടുകയും 2CaSO 4 H 2 O എന്ന രചനയുടെ ഹൈഡ്രേറ്റിലേക്ക് പോകുകയും ചെയ്യുന്നു. അലബസ്റ്റർ, ഒരു പാസ്തി പിണ്ഡത്തിൽ വെള്ളത്തിൽ കലർ\u200cന്ന് കുറച്ച് സമയത്തിനുശേഷം വീണ്ടും കഠിനമാക്കുകയും CaSO 4 2H 2 O. ആയി മാറുകയും ചെയ്യുന്നു ജിപ്\u200cസം നിർമ്മാണത്തിൽ (പ്ലാസ്റ്റർ) വ്യാപകമായി ഉപയോഗിക്കുന്നു. ^ മഗ്നീഷ്യം സൾഫേറ്റ്MgSO 4 സമുദ്രജലത്തിൽ കാണപ്പെടുന്നു, ഇത് അതിന്റെ കയ്പേറിയ രുചിക്ക് കാരണമാകുന്നു. കയ്പുള്ള ഉപ്പ് എന്നറിയപ്പെടുന്ന ക്രിസ്റ്റലിൻ ഹൈഡ്രേറ്റ് ഒരു പോഷകസമ്പുഷ്ടമായി ഉപയോഗിക്കുന്നു. വിട്രിയോൾ- ലോഹ സൾഫേറ്റുകളുടെ ക്രിസ്റ്റലിൻ ഹൈഡ്രേറ്റുകളുടെ സാങ്കേതിക നാമം Fe, Cu, Zn, Ni, Co (നിർജ്ജലീകരണം ചെയ്ത ലവണങ്ങൾ വിട്രിയോളല്ല). നീല വിട്രിയോൾനീല നിറമുള്ള ഒരു വിഷ പദാർത്ഥമാണ് CuSO 4 5H 2 O. ചെടികൾ അതിന്റെ നേർപ്പിച്ച ലായനി ഉപയോഗിച്ച് തളിക്കുകയും വിത്ത് വിതയ്ക്കുന്നതിന് മുമ്പ് അച്ചാറിടുകയും ചെയ്യുന്നു. അയൺ സൾഫേറ്റ്ഇളം പച്ച പദാർത്ഥമാണ് FeSO 4 7H 2 O. ചെടികളുടെ കീടങ്ങളെ നിയന്ത്രിക്കാനും മഷി, മിനറൽ പെയിന്റുകൾ മുതലായവ തയ്യാറാക്കാനും ഇവ ഉപയോഗിക്കുന്നു. സിങ്ക് സൾഫേറ്റ്മിനറൽ പെയിന്റുകളുടെ നിർമ്മാണത്തിലും അരിപ്പ അച്ചടിയിലും മരുന്നിലും ZnSO 4 7H 2 O ഉപയോഗിക്കുന്നു. ^ 4.5. സൾഫ്യൂറിക് ആസിഡ് എസ്റ്ററുകൾ. സോഡിയം തയോസൾഫേറ്റ് സൾഫ്യൂറിക് ആസിഡ് എസ്റ്ററുകളിൽ ഡയൽ\u200cകൈൽ സൾഫേറ്റുകൾ (RO 2) SO 2 ഉൾപ്പെടുന്നു. ഇവ ഉയർന്ന തിളപ്പിക്കുന്ന ദ്രാവകങ്ങളാണ്; വെള്ളത്തിൽ ലയിക്കുന്നവ; ക്ഷാരത്തിന്റെ സാന്നിധ്യത്തിൽ മദ്യവും സൾഫ്യൂറിക് ആസിഡിന്റെ ലവണങ്ങളും രൂപം കൊള്ളുന്നു. ലോവർ ഡയൽ\u200cകൈൽ സൾഫേറ്റുകൾ ആൽക്കൈലേറ്റിംഗ് ഏജന്റുകളാണ്. ഡൈതൈൽ സൾഫേറ്റ്(സി 2 എച്ച് 5) 2 എസ്ഒ 4. ദ്രവണാങ്കം -26 ° C, ചുട്ടുതിളക്കുന്ന സ്ഥലം 210 ° C, മദ്യത്തിൽ ലയിക്കുന്നു, വെള്ളത്തിൽ ലയിക്കില്ല. എഥനോളുമായുള്ള സൾഫ്യൂറിക് ആസിഡിന്റെ പ്രതിപ്രവർത്തനം വഴി ലഭിക്കുന്നു. ഓർഗാനിക് സിന്തസിസിലെ ഒരു എഥിലൈറ്റിംഗ് ഏജന്റാണ് ഇത്. ചർമ്മത്തിലൂടെ തുളച്ചുകയറുന്നു. ഡൈമെഥൈൽ സൾഫേറ്റ്(CH 3) 2 SO 4. ദ്രവണാങ്കം -26.8 ° C, ചുട്ടുതിളക്കുന്ന സ്ഥലം 188.5. C. മദ്യത്തിൽ ലയിക്കുന്നു, മോശമായി വെള്ളത്തിൽ. ഒരു ലായകത്തിന്റെ അഭാവത്തിൽ അമോണിയയുമായി പ്രതിപ്രവർത്തിക്കുന്നു (ഒരു സ്ഫോടനത്തോടെ); ചില ആരോമാറ്റിക് സംയുക്തങ്ങൾ സൾഫോണേറ്റ് ചെയ്യുന്നു, ഉദാഹരണത്തിന് ഫിനോൾ എസ്റ്ററുകൾ. 150 ° C ന് മെത്തനോളുമായി 60% ഓലിയത്തിന്റെ പ്രതിപ്രവർത്തനം വഴി ലഭിക്കുന്നു. ഇത് ഓർഗാനിക് സിന്തസിസിലെ ഒരു മെത്തിലൈറ്റിംഗ് ഏജന്റാണ്. കാൻസർ, കണ്ണുകൾ, ചർമ്മം, ശ്വസനവ്യവസ്ഥ എന്നിവയെ ബാധിക്കുന്നു. ^ സോഡിയം തയോസൾഫേറ്റ് Na 2 S 2 O 3
തയോസൾഫ്യൂറിക് ആസിഡ് ഉപ്പ്, അതിൽ രണ്ട് സൾഫർ ആറ്റങ്ങൾക്ക് വ്യത്യസ്ത ഓക്സീകരണ അവസ്ഥകളുണ്ട്: +6, -2. സ്ഫടിക പദാർത്ഥം, വെള്ളത്തിൽ ലയിക്കുന്നു. ഹൈപ്പോസൾഫൈറ്റായി സാധാരണയായി ഉപയോഗിക്കുന്ന ക്രിസ്റ്റലിൻ ഹൈഡ്രേറ്റ് Na 2 S 2 O 3 5H 2 O രൂപത്തിൽ ലഭ്യമാണ്. തിളപ്പിക്കുമ്പോൾ സൾഫറുമായി സോഡിയം സൾഫൈറ്റിന്റെ പ്രതിപ്രവർത്തനം വഴി ലഭിക്കുന്നു: Na 2 SO 3 + S \u003d Na 2 S 2 O 3 തയോസൾഫ്യൂറിക് ആസിഡിനെപ്പോലെ, ഇത് ശക്തമായ കുറയ്ക്കുന്ന ഘടകമാണ്.ഇത് ക്ലോറിൻ വഴി സൾഫ്യൂറിക് ആസിഡിലേക്ക് എളുപ്പത്തിൽ ഓക്സീകരിക്കപ്പെടുന്നു: Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O \u003d 2H 2 SO 4 + 2NaCl + 6НСl ക്ലോറിൻ ആഗിരണം ചെയ്യുന്നതിനായി സോഡിയം തയോസൾഫേറ്റിന്റെ ഉപയോഗം (ആദ്യത്തെ ഗ്യാസ് മാസ്കുകളിൽ) ഈ പ്രതികരണത്തെ അടിസ്ഥാനമാക്കിയുള്ളതായിരുന്നു. ദുർബലമായ ഓക്സിഡൈസിംഗ് ഏജന്റുകളുള്ള സോഡിയം തയോസൾഫേറ്റിന്റെ ഓക്സീകരണം അല്പം വ്യത്യസ്തമാണ്. ഈ സാഹചര്യത്തിൽ, ടെട്രാത്തിയോണിക് ആസിഡിന്റെ ലവണങ്ങൾ രൂപം കൊള്ളുന്നു, ഉദാഹരണത്തിന്: 2Na 2 S 2 O 3 + I 2 \u003d Na 2 S 4 O 6 + 2NaI NaHSO 3, സൾഫർ ഡൈകൾ, സൾഫറിൽ നിന്നുള്ള വ്യാവസായിക വാതകങ്ങൾ ശുദ്ധീകരിക്കൽ എന്നിവയിലെ ഉപോൽപ്പന്നമാണ് സോഡിയം തയോസൾഫേറ്റ്. തുണി ബ്ലീച്ചിംഗ് ചെയ്ത ശേഷം ക്ലോറിൻറെ അംശം നീക്കംചെയ്യാനും അയിരുകളിൽ നിന്ന് വെള്ളി വേർതിരിച്ചെടുക്കാനും ഇത് ഉപയോഗിക്കുന്നു; ഇത് ഫോട്ടോഗ്രാഫിയിലെ ഒരു ഫിക്സർ, അയഡോമെട്രിയിലെ ഒരു റിയാക്ടന്റ്, ആർസെനിക്, മെർക്കുറി, ആൻറി-ഇൻഫ്ലമേറ്ററി ഏജന്റ് എന്നിവയുടെ സംയുക്തങ്ങൾ ഉപയോഗിച്ച് വിഷം കഴിക്കുന്നതിനുള്ള ഒരു മറുമരുന്നാണ്. SO2 തന്മാത്രയുടെ ഘടന SO2 തന്മാത്രയുടെ ഘടന ഓസോൺ തന്മാത്രയുടെ ഘടനയ്ക്ക് സമാനമാണ്. സൾഫർ ആറ്റം sp2 ഹൈബ്രിഡൈസേഷന്റെ അവസ്ഥയിലാണ്, ഭ്രമണപഥങ്ങളുടെ ക്രമീകരണത്തിന്റെ ആകൃതി ഒരു സാധാരണ ത്രികോണമാണ്, തന്മാത്രയുടെ ആകൃതി കോണാകൃതിയാണ്. സൾഫർ ആറ്റത്തിൽ ഒരു ഷെയർ ചെയ്യാത്ത ഇലക്ട്രോൺ ജോഡി ഉണ്ട്. S - O ബോണ്ട് നീളം 0.143 nm, വാലൻസ് ആംഗിൾ 119.5 is. ഘടന ഇനിപ്പറയുന്ന അനുരണന ഘടനകളുമായി യോജിക്കുന്നു: ഓസോണിൽ നിന്ന് വ്യത്യസ്തമായി, എസ് - ഒ ബോണ്ടിന്റെ ഗുണിതം 2 ആണ്, അതായത്, ആദ്യത്തെ അനുരണന ഘടന പ്രധാന സംഭാവന നൽകുന്നു. ഉയർന്ന താപ സ്ഥിരതയാണ് തന്മാത്രയുടെ സവിശേഷത.
സൾഫർ സംയുക്തങ്ങൾ +4 - റെഡോക്സ് ദ്വൈതത പ്രകടമാക്കുന്നു, പക്ഷേ ഗുണവിശേഷതകൾ കുറയ്ക്കുന്നതിൽ മുൻ\u200cതൂക്കം. 1. ഓക്സിജനുമായുള്ള SO2 ന്റെ പ്രതിപ്രവർത്തനം 2 എസ് + 4О2 + О 2 എസ് + 6О 2. ഹൈഡ്രജൻ സൾഫൈഡിലൂടെ SO2 കടന്നുപോകുന്നതിലൂടെ സൾഫർ രൂപം കൊള്ളുന്നു. S + 4O2 + 2H2S-2 → 3So + 2 H2O 4 S + 4 + 4 → അതിനാൽ 1 - ഓക്സിഡൈസിംഗ് ഏജന്റ് (റിഡക്ഷൻ) S-2 - 2 → അതിനാൽ 2 - കുറയ്ക്കുന്ന ഏജന്റ് (ഓക്സീകരണം) 3. അന്തരീക്ഷ ഓക്സിജൻ സൾഫ്യൂറിക് ആസിഡിലേക്ക് സൾഫ്യൂറിക് ആസിഡ് സാവധാനം ഓക്സീകരിക്കപ്പെടുന്നു. 2H2S + 4O3 + 2O 2H2S + 6O 4 S + 4 - 2 → S + 6 2 - കുറയ്ക്കുന്ന ഏജന്റ് (ഓക്സീകരണം) + 4 → 2О-2 1 - ഓക്സിഡൈസിംഗ് ഏജന്റ് (റിഡക്ഷൻ) സ്വീകരിക്കുന്നു: 1) വ്യവസായത്തിൽ സൾഫർ ഓക്സൈഡ് (IV): സൾഫർ കത്തുന്ന: പൈറൈറ്റ് റോസ്റ്റിംഗ്: 4FeS2 + 11O2 \u003d 2Fe2O3 ലബോറട്ടറിയിൽ: Na2SO3 + H2SO4 \u003d Na2SO4 + SO2 + H2O സൾഫറസ് വാതകം, അഴുകൽ തടയുന്നു, മലിനീകരണം, രോഗകാരിയായ മൈക്രോഫ്ലോറയുമൊത്തുള്ള മുന്തിരി ടിഷ്യുവിന്റെ സ്ക്രാപ്പുകൾ എന്നിവ സുഗമമാക്കുന്നു, കൂടാതെ എഥൈൽ മദ്യത്തിന്റെ വിളവ് വർദ്ധിപ്പിക്കുന്നതിനും മറ്റ് ലഹരി അഴുകൽ ഉൽ\u200cപന്നങ്ങളുടെ ഘടന മെച്ചപ്പെടുത്തുന്നതിനും ശുദ്ധമായ യീസ്റ്റ് സംസ്കാരങ്ങളിൽ മദ്യം പുളിപ്പിക്കാൻ അനുവദിക്കുന്നു. ഈ രീതിയിൽ സൾഫർ ഡയോക്സൈഡിന്റെ പങ്ക് പരിസ്ഥിതിയെ മെച്ചപ്പെടുത്തുന്ന ആന്റിസെപ്റ്റിക് പ്രവർത്തനങ്ങളിൽ മാത്രമല്ല, വൈൻ പുളിക്കുന്നതിനും സംഭരിക്കുന്നതിനുമുള്ള സാങ്കേതിക സാഹചര്യങ്ങളുടെ മെച്ചപ്പെടുത്തലിലേക്കും വ്യാപിക്കുന്നു. ഈ അവസ്ഥകൾ, സൾഫർ ഡൈ ഓക്സൈഡിന്റെ ശരിയായ ഉപയോഗത്തിലൂടെ (വായുവുമായി സമ്പർക്കത്തിന്റെ അളവും സമയവും പരിമിതപ്പെടുത്തുന്നു), വൈനുകളുടെയും ജ്യൂസുകളുടെയും ഗുണനിലവാരം, അവയുടെ സ ma രഭ്യവാസന, രുചി, അതുപോലെതന്നെ സുതാര്യത, നിറം - വൈൻ, ജ്യൂസ് എന്നിവയുടെ സ്ഥിരതയുമായി ബന്ധപ്പെട്ട പ്രക്ഷുബ്ധത. വായു മലിനീകരണമാണ് സൾഫർ വാതകം. ഫോസിൽ ഇന്ധനങ്ങൾ കത്തിക്കുമ്പോൾ ഇത് എല്ലാ plants ർജ്ജ നിലയങ്ങളും പുറത്തുവിടുന്നു. മെറ്റലർജിക്കൽ വ്യവസായവും (കോക്കിംഗ് കൽക്കരി ഉറവിടം) അതുപോലെ തന്നെ നിരവധി രാസ വ്യവസായങ്ങളും (ഉദാഹരണത്തിന്, സൾഫ്യൂറിക് ആസിഡ് ഉത്പാദനം) സൾഫർ വാതകം പുറന്തള്ളാൻ കഴിയും. പുരാതന സസ്യങ്ങളുടെ പ്രോട്ടീനുകളുടെ ഭാഗമായ സൾഫർ അടങ്ങിയ അമിനോ ആസിഡുകളുടെ വിഘടനത്തിനിടയിലാണ് ഇത് രൂപം കൊള്ളുന്നത്, ഇത് കൽക്കരി, എണ്ണ, എണ്ണ ഷെയ്ൽ എന്നിവയുടെ നിക്ഷേപമായി. അപ്ലിക്കേഷൻ കണ്ടെത്തുന്നു വിവിധ ഉൽ\u200cപ്പന്നങ്ങൾ\u200c ബ്ലീച്ചിംഗിനായി വ്യവസായത്തിൽ\u200c: തുണി, സിൽക്ക്, പേപ്പർ പൾപ്പ്, തൂവലുകൾ, വൈക്കോൽ, മെഴുക്, കുറ്റിരോമങ്ങൾ, കുതിരസവാരി, ഭക്ഷ്യ ഉൽ\u200cപ്പന്നങ്ങൾ, പഴങ്ങളും ടിന്നിലടച്ച ഭക്ഷണവും അണുവിമുക്തമാക്കുന്നതിന്. മുതലായവ. ഒരു ഉപോൽപ്പന്നമെന്ന നിലയിൽ, സി. നിരവധി വ്യവസായങ്ങളിലെ വർക്കിംഗ് റൂമുകളുടെ വായു: സൾഫ്യൂറിക് ലോഹങ്ങൾ അടങ്ങിയ അയിരുകൾ വറുക്കുമ്പോൾ സൾഫ്യൂറിക് ആസിഡ്, സെല്ലുലോസ്, മെറ്റൽ പ്ലാന്റുകളിലെ അച്ചാർ സസ്യങ്ങൾ, ഗ്ലാസ്, അൾട്രാമറൈൻ മുതലായവ നിർമ്മിക്കുന്നതിൽ, പലപ്പോഴും സി. ബോയിലർ റൂമുകളുടെയും ആഷ് റൂമുകളുടെയും വായുവിൽ അടങ്ങിയിരിക്കുന്നു. സോഡർ കത്തുന്നതിലൂടെ ഇത് രൂപം കൊള്ളുന്നു അസ്ഛിഹ് സൾഫർ തീക്കനൽ. വെള്ളത്തിൽ ലയിക്കുമ്പോൾ ദുർബലവും അസ്ഥിരവുമാകുന്നു. സൾഫ്യൂറിക് ആസിഡ് H2SO3 (ജലീയ ലായനിയിൽ മാത്രം നിലനിൽക്കുന്നു) SO2 + H2O H2SO3 സൾഫ്യൂറിക് ആസിഡ് ഘട്ടങ്ങളായി വിഘടിക്കുന്നു: H2SO3 ↔ H + + HSO3- (ആദ്യ ഘട്ടം, ഹൈഡ്രോസൾഫൈറ്റ് - അയോൺ രൂപം കൊള്ളുന്നു) HSO3- ↔ H + + SO32- (രണ്ടാം ഘട്ടം, സൾഫൈറ്റ് അയോൺ രൂപം കൊള്ളുന്നു) H2SO3 രണ്ട് വരികളുള്ള ലവണങ്ങൾ ഉണ്ടാക്കുന്നു - ഇടത്തരം (സൾഫൈറ്റുകൾ), ആസിഡ് (ഹൈഡ്രോസൾഫൈറ്റുകൾ). സൾഫ്യൂറിക് ആസിഡ് ലവണങ്ങളോടുള്ള ഒരു ഗുണപരമായ പ്രതികരണമാണ് ശക്തമായ ആസിഡുള്ള ഉപ്പിന്റെ പ്രതിപ്രവർത്തനം, കൂടാതെ ദുർഗന്ധമുള്ള SO2 വാതകം പുറത്തുവിടുന്നു: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O 2H + + SO32- → SO2 + H2O സൾഫർ ഓക്സൈഡ് (IV) സവിശേഷതകൾ പ്രദർശിപ്പിക്കുന്നു 1) അടിസ്ഥാന ഓക്സൈഡ് മാത്രം 2) ആംഫോട്ടറിക് ഓക്സൈഡ് 3) ആസിഡ് ഓക്സൈഡ് 4) ഉപ്പ് രൂപപ്പെടാത്ത ഓക്സൈഡ് ഉത്തരം: 3 വിശദീകരണം: സൾഫറിന് +4 ചാർജ് ഉള്ള ഒരു ആസിഡ് ഓക്സൈഡ് (നോൺ-മെറ്റൽ ഓക്സൈഡ്) ആണ് സൾഫർ ഓക്സൈഡ് (IV) SO 2. ഈ ഓക്സൈഡ് H 2 SO 3 ൽ സൾഫറസ് ആസിഡ് ലവണങ്ങൾ ഉണ്ടാക്കുന്നു, കൂടാതെ വെള്ളവുമായി പ്രതിപ്രവർത്തിക്കുമ്പോൾ H 2 SO 3 സൾഫ്യൂറിക് ആസിഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു. NO, SiO, N 2 O (നൈട്രസ് ഓക്സൈഡ്), CO എന്നിവ ഉപ്പ് രൂപപ്പെടാത്ത ഓക്സൈഡുകളിൽ (അസിഡിക്, അടിസ്ഥാന, ആംഫോട്ടറിക് ഗുണങ്ങൾ അല്ലെങ്കിൽ ഉപ്പ് രൂപപ്പെടുന്നവ കാണിക്കാത്ത ഓക്സൈഡുകൾ) ഉൾപ്പെടുന്നു. +1, +2 ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ആദ്യ ഗ്രൂപ്പിലെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (ക്ഷാര ലോഹങ്ങൾ) ലി-ഫ്ര, രണ്ടാമത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (എം\u200cജി, ആൽക്കലൈൻ എർത്ത് ലോഹങ്ങൾ) എം\u200cജി-റാ, ലോവർ ഓക്\u200cസിഡേഷൻ അവസ്ഥകളിലെ ട്രാൻസിഷൻ മെറ്റൽ ഓക്സൈഡുകൾ എന്നിവ ഇതിൽ ഉൾപ്പെടുന്നു. ഉപ്പ് രൂപപ്പെടുന്ന ഓക്സൈഡുകളാണ് ആംഫോട്ടറിക് ഓക്സൈഡുകൾ, ഇത് വ്യവസ്ഥകളെ ആശ്രയിച്ച് അടിസ്ഥാന അല്ലെങ്കിൽ അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു (അതായത്, ആംഫോട്ടെറിസിറ്റി കാണിക്കുന്നു). സംക്രമണ ലോഹങ്ങളാൽ രൂപീകരിച്ചത്. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലെ ലോഹങ്ങൾ സാധാരണയായി +3 മുതൽ +4 വരെ ഓക്സീകരണ നില കാണിക്കുന്നു, ZnO, BeO, SnO, PbO എന്നിവ ഒഴികെ. ആസിഡിക്, അടിസ്ഥാന ഓക്സൈഡ് എന്നിവ യഥാക്രമം 2) CO 2, അൽ 2 O 3 ഉത്തരം: 1 വിശദീകരണം: ആസിഡ് ഓക്സൈഡുകൾ - അസിഡിറ്റി ഉള്ള ഗുണങ്ങൾ പ്രകടിപ്പിക്കുകയും അനുബന്ധ ഓക്സിജൻ അടങ്ങിയ ആസിഡുകൾ രൂപപ്പെടുകയും ചെയ്യുന്ന ഓക്സൈഡുകൾ. അവതരിപ്പിച്ച പട്ടികയിൽ\u200c, ഇവ ഉൾ\u200cപ്പെടുന്നു: SO 2, SO 3, CO 2. ജലവുമായി സംവദിക്കുമ്പോൾ അവ ഇനിപ്പറയുന്ന ആസിഡുകൾ ഉണ്ടാക്കുന്നു: SO 2 + H 2 O \u003d H 2 SO 3 (സൾഫറസ് ആസിഡ്) SO 3 + H 2 O \u003d H 2 SO 4 (സൾഫ്യൂറിക് ആസിഡ്) CO 2 + H 2 O \u003d H 2 CO 3 (കാർബോണിക് ആസിഡ്) +1, +2 ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ആദ്യ ഗ്രൂപ്പിലെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (ക്ഷാര ലോഹങ്ങൾ) ലി-ഫ്ര, രണ്ടാമത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (എം\u200cജി, ആൽക്കലൈൻ എർത്ത് ലോഹങ്ങൾ) എം\u200cജി-റാ, ലോവർ ഓക്\u200cസിഡേഷൻ അവസ്ഥകളിലെ ട്രാൻസിഷൻ മെറ്റൽ ഓക്സൈഡുകൾ എന്നിവ ഇതിൽ ഉൾപ്പെടുന്നു. അവതരിപ്പിച്ച പട്ടികയിൽ നിന്ന് പ്രധാന ഓക്സൈഡുകളിൽ ഇവ ഉൾപ്പെടുന്നു: MgO, FeO. ഉപ്പ് രൂപപ്പെടുന്ന ഓക്സൈഡുകളാണ് ആംഫോട്ടറിക് ഓക്സൈഡുകൾ, ഇത് വ്യവസ്ഥകളെ ആശ്രയിച്ച് അടിസ്ഥാന അല്ലെങ്കിൽ അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു (അതായത്, ആംഫോട്ടെറിസിറ്റി കാണിക്കുന്നു). സംക്രമണ ലോഹങ്ങളാൽ രൂപീകരിച്ചത്. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലെ ലോഹങ്ങൾ സാധാരണയായി +3 മുതൽ +4 വരെ ഓക്സീകരണ നില കാണിക്കുന്നു, ZnO, BeO, SnO, PbO എന്നിവ ഒഴികെ. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലേക്ക് അവതരിപ്പിച്ച പട്ടികയിൽ നിന്ന്: അൽ 2 ഒ 3, ZnO. സൾഫർ ഓക്സൈഡ് (VI) രണ്ട് വസ്തുക്കളുമായി പ്രതിപ്രവർത്തിക്കുന്നു: 1) വെള്ളവും ഹൈഡ്രോക്ലോറിക് ആസിഡും 2) ഓക്സിജനും മഗ്നീഷ്യം ഓക്സൈഡും 3) കാൽസ്യം ഓക്സൈഡ്, സോഡിയം ഹൈഡ്രോക്സൈഡ് ഉത്തരം: 3 വിശദീകരണം: സൾഫർ ഓക്സൈഡ് (VI) SO 3 (സൾഫർ ഓക്സിഡേഷൻ സ്റ്റേറ്റ് +6) ഒരു ആസിഡ് ഓക്സൈഡാണ്, ഇത് വെള്ളവുമായി പ്രതിപ്രവർത്തിച്ച് അനുബന്ധ സൾഫ്യൂറിക് ആസിഡ് H 2 SO 4 ഉൽ\u200cപാദിപ്പിക്കുന്നു (സൾഫർ ഓക്സിഡേഷൻ അവസ്ഥയും +6): SO 3 + H 2 O \u003d H 2 SO 4 ആസിഡ് ഓക്സൈഡ് SO 3 ആസിഡുകളുമായി പ്രതിപ്രവർത്തിക്കാത്തതിനാൽ, അതായത്, പ്രതികരണം HCl- മായി മുന്നോട്ട് പോകുന്നില്ല. SO 3 ലെ സൾഫർ +6 ന്റെ ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥ കാണിക്കുന്നു (മൂലക ഗ്രൂപ്പിന്റെ എണ്ണത്തിന് തുല്യമാണ്), അതിനാൽ SO 3 ഓക്സിജനുമായി പ്രതിപ്രവർത്തിക്കുന്നില്ല (ഓക്സിജൻ +6 ന്റെ ഓക്സീകരണ അവസ്ഥയിൽ സൾഫറിനെ ഓക്സിഡൈസ് ചെയ്യുന്നില്ല). അടിസ്ഥാന ഓക്സൈഡ് MgO ഉപയോഗിച്ച്, അനുബന്ധ ഉപ്പ് രൂപം കൊള്ളുന്നു - മഗ്നീഷ്യം സൾഫേറ്റ് MgSO 4: MgO + SO 3 \u003d MgSO 4 ഓക്സൈഡ് എസ്ഒ 3 അസിഡിക് ആയതിനാൽ, ഇത് അടിസ്ഥാന ഓക്സൈഡുകളുമായും അടിസ്ഥാന ലവണങ്ങൾ രൂപപ്പെടുന്നതുമായും പ്രതിപ്രവർത്തിക്കുന്നു: MgO + SO 3 \u003d MgSO 4 NaOH + SO 3 \u003d NaHSO 4 അല്ലെങ്കിൽ 2NaOH + SO 3 \u003d Na 2 SO 4 + H 2 O. മുകളിൽ സൂചിപ്പിച്ചതുപോലെ, SO 3 വെള്ളവുമായി പ്രതിപ്രവർത്തിച്ച് സൾഫ്യൂറിക് ആസിഡ് ഉണ്ടാക്കുന്നു. CuSO 3 സംക്രമണ ലോഹവുമായി സംവദിക്കുന്നില്ല. കാർബൺ മോണോക്സൈഡ് (IV) രണ്ട് വസ്തുക്കളുമായി പ്രതിപ്രവർത്തിക്കുന്നു: 1) വെള്ളവും കാൽസ്യം ഓക്സൈഡും 2) ഓക്സിജനും സൾഫർ ഓക്സൈഡും (IV) 3) പൊട്ടാസ്യം സൾഫേറ്റ്, സോഡിയം ഹൈഡ്രോക്സൈഡ് 4) ഫോസ്ഫോറിക് ആസിഡും ഹൈഡ്രജനും ഉത്തരം: 1 വിശദീകരണം: കാർബൺ മോണോക്സൈഡ് (IV) CO 2 ഒരു ആസിഡ് ഓക്സൈഡാണ്, അതിനാൽ ഇത് ജലവുമായി പ്രതിപ്രവർത്തിച്ച് അസ്ഥിരമായ കാർബോണിക് ആസിഡ് H 2 CO 3 ഉം കാൽസ്യം ഓക്സൈഡുമായി കാൽസ്യം കാർബണേറ്റ് CaCO 3 രൂപപ്പെടുന്നു: CO 2 + H 2 O \u003d H 2 CO 3 CO 2 + CaO \u003d CaCO 3 കാർബൺ ഡൈ ഓക്സൈഡ് CO 2 മായി പ്രതിപ്രവർത്തിക്കുന്നില്ല, കാരണം ഉയർന്ന ഓക്സിഡേഷൻ അവസ്ഥയിലുള്ള ഒരു മൂലകത്തെ ഓക്സിജന് ഓക്സിഡൈസ് ചെയ്യാൻ കഴിയില്ല (കാർബണിനെ സംബന്ധിച്ചിടത്തോളം ഇത് സ്ഥിതിചെയ്യുന്ന ഗ്രൂപ്പിന്റെ എണ്ണത്തിൽ +4 ആണ്). സൾഫർ ഡയോക്സൈഡ് (IV) SO 2 യുമായി യാതൊരു പ്രതികരണവുമില്ല, കാരണം ആസിഡ് ഓക്സൈഡ് ആയതിനാൽ CO 2 ഓക്സിഡുമായി പ്രതിപ്രവർത്തിക്കുന്നില്ല, അസിഡിറ്റി ഗുണങ്ങളും ഉണ്ട്. കാർബൺ ഡൈ ഓക്സൈഡ് CO 2 ലവണങ്ങളുമായി ഇടപഴകുന്നില്ല (ഉദാഹരണത്തിന്, പൊട്ടാസ്യം സൾഫേറ്റ് K 2 SO 4), എന്നാൽ ക്ഷാരങ്ങളുമായി സംവദിക്കുന്നു, കാരണം ഇതിന് അടിസ്ഥാന ഗുണങ്ങളുണ്ട്. പ്രതിപ്രവർത്തനം ഒരു അസിഡിക് അല്ലെങ്കിൽ ഇടത്തരം ഉപ്പ് രൂപപ്പെടുന്നതിലൂടെ തുടരുന്നു, ഇത് ഘടകങ്ങളുടെ അമിതമോ അഭാവമോ അനുസരിച്ച്: NaOH + CO 2 \u003d NaHCO 3 അല്ലെങ്കിൽ 2NaOH + CO 2 \u003d Na 2 CO 3 + H 2 O. CO2, ഒരു ആസിഡ് ഓക്സൈഡ് ആയതിനാൽ അസിഡിക് ഓക്സൈഡുകളുമായോ ആസിഡുകളുമായോ പ്രതിപ്രവർത്തിക്കുന്നില്ല, അതിനാൽ കാർബൺ ഡൈ ഓക്സൈഡും ഫോസ്ഫോറിക് ആസിഡും തമ്മിലുള്ള പ്രതിപ്രവർത്തനം H 3 PO 4 സംഭവിക്കുന്നില്ല. CO 2 ഹൈഡ്രജൻ മീഥെയ്നിലേക്കും വെള്ളത്തിലേക്കും കുറയ്ക്കുന്നു: CO 2 + 4H 2 \u003d CH 4 + 2H 2 O. മൂലകത്തിന്റെ ഉയർന്ന ഓക്സൈഡ് ആണ് പ്രധാന സവിശേഷതകൾ കാണിക്കുന്നത് ഉത്തരം: 3 വിശദീകരണം: പ്രധാന സവിശേഷതകൾ പ്രധാന ഓക്സൈഡുകൾ കാണിക്കുന്നു - +1, +2 എന്നിവയുടെ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകൾ. ഇവയിൽ ഇവ ഉൾപ്പെടുന്നു: അവതരിപ്പിച്ച ഓപ്ഷനുകളിൽ, ബേരിയം ഓക്സൈഡ് BaO മാത്രമാണ് പ്രധാന ഓക്സൈഡുകളിൽ ഉള്ളത്. സൾഫർ, നൈട്രജൻ, കാർബൺ എന്നിവയുടെ മറ്റെല്ലാ ഓക്സൈഡുകളും അസിഡിറ്റി അല്ലെങ്കിൽ ഉപ്പ് രൂപപ്പെടാത്തവയാണ്: CO, NO, N 2 O. + 6 ഉം അതിനുമുകളിലും ഓക്\u200cസിഡേഷൻ അവസ്ഥയുള്ള മെറ്റൽ ഓക്സൈഡുകൾ 1) ഉപ്പ് ഇതര രൂപീകരണം 2) പ്രധാനം 3) ആംഫോട്ടറിക് ഉത്തരം: 4 വിശദീകരണം:
ആസിഡ് ഓക്സൈഡുകൾ (അൺഹൈഡ്രൈഡുകൾ) ഓക്സൈഡുകളാണ്, ഇത് അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുകയും ഓക്സിജൻ അടങ്ങിയ ആസിഡുകൾ രൂപപ്പെടുത്തുകയും ചെയ്യുന്നു. സാധാരണ നോൺ-ലോഹങ്ങളും ചില സംക്രമണ ഘടകങ്ങളും ഉപയോഗിച്ച് രൂപപ്പെടുത്തി. അസിഡിക് ഓക്സൈഡുകളിലെ ഘടകങ്ങൾ സാധാരണയായി +4 മുതൽ +7 വരെ ഓക്സീകരണ അവസ്ഥ കാണിക്കുന്നു. അതിനാൽ, +6 ഓക്സിഡേഷൻ അവസ്ഥയിലെ മെറ്റൽ ഓക്സൈഡിന് അസിഡിറ്റി ഗുണങ്ങളുണ്ട്. ഒരു ഓക്സൈഡ് ഉപയോഗിച്ച് സൂത്രവാക്യം പ്രകടമാക്കുന്നു ഉത്തരം: 1 വിശദീകരണം: ആസിഡ് ഓക്സൈഡുകൾ (അൺഹൈഡ്രൈഡുകൾ) ഓക്സൈഡുകളാണ്, ഇത് അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുകയും ഓക്സിജൻ അടങ്ങിയ ആസിഡുകൾ രൂപപ്പെടുത്തുകയും ചെയ്യുന്നു. സാധാരണ നോൺ-ലോഹങ്ങളും ചില സംക്രമണ ഘടകങ്ങളും ഉപയോഗിച്ച് രൂപപ്പെടുത്തി. അസിഡിക് ഓക്സൈഡുകളിലെ ഘടകങ്ങൾ സാധാരണയായി +4 മുതൽ +7 വരെ ഓക്സീകരണ അവസ്ഥ കാണിക്കുന്നു. അതിനാൽ, സിലിക്കൺ +6 ചാർജ്ജ് ഉള്ള സിലിക്കൺ ഓക്സൈഡ് SiO 2 ന് അസിഡിറ്റി ഗുണങ്ങളുണ്ട്. N 2 O, NO, SiO, CO എന്നിവയാണ് ഉപ്പ് രൂപപ്പെടാത്ത ഓക്സൈഡുകൾ. ഉപ്പ് രൂപപ്പെടാത്ത ഓക്സൈഡാണ് CO. +1, +2 എന്നിവയുടെ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ഇവയിൽ ഇവ ഉൾപ്പെടുന്നു: - ആദ്യത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ക്ഷാരഗുണത്തിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (ക്ഷാര ലോഹങ്ങൾ) Li - Fr; - രണ്ടാമത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (Mg, ക്ഷാര എർത്ത് ലോഹങ്ങൾ) Mg - Ra; - താഴ്ന്ന ഓക്സിഡേഷൻ അവസ്ഥകളിലെ സംക്രമണ ലോഹങ്ങളുടെ ഓക്സൈഡുകൾ. BaO അടിസ്ഥാന ഓക്സൈഡുകളുടേതാണ്. ഉപ്പ് രൂപപ്പെടുന്ന ഓക്സൈഡുകളാണ് ആംഫോട്ടറിക് ഓക്സൈഡുകൾ, ഇത് വ്യവസ്ഥകളെ ആശ്രയിച്ച് അടിസ്ഥാന അല്ലെങ്കിൽ അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു (അതായത്, ആംഫോട്ടെറിസിറ്റി കാണിക്കുന്നു). സംക്രമണ ലോഹങ്ങളാൽ രൂപീകരിച്ചത്. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലെ ലോഹങ്ങൾ സാധാരണയായി +3 മുതൽ +4 വരെ ഓക്സീകരണ നില കാണിക്കുന്നു, ZnO, BeO, SnO, PbO എന്നിവ ഒഴികെ. അലുമിന അൽ 2 ഒ 3 ആണ് ആംഫോട്ടറിക് ഓക്സൈഡ്. അതിന്റെ ആംഫോട്ടറിക് സംയുക്തങ്ങളിലെ ക്രോമിയത്തിന്റെ ഓക്സീകരണ നില ഉത്തരം: 3 വിശദീകരണം: നാലാമത്തെ കാലഘട്ടത്തിലെ ആറാമത്തെ ഗ്രൂപ്പിലെ ഒരു ഉപഗ്രൂപ്പിന്റെ ഘടകമാണ് ക്രോമിയം. 0, +2, +3, +4, +6 എന്നീ ഓക്\u200cസിഡേഷൻ അവസ്ഥകളാണ് ഇതിന്റെ സവിശേഷത. ഓക്സിഡേഷൻ +2 പ്രധാന ഗുണങ്ങളുള്ള CrO ഓക്സൈഡിനോട് യോജിക്കുന്നു. ഓക്സിഡേഷൻ അവസ്ഥ +3 ആംഫോട്ടറിക് ഓക്സൈഡ് Cr 2 O 3, ഹൈഡ്രോക്സൈഡ് Cr (OH) 3 എന്നിവയുമായി യോജിക്കുന്നു. ക്രോമിയത്തിന്റെ ഏറ്റവും സ്ഥിരതയുള്ള ഓക്സീകരണ അവസ്ഥയാണിത്. ഓക്സിഡേഷൻ അവസ്ഥ +6 ആസിഡ് ക്രോമിയം ഓക്സൈഡ് (VI) CrO 3, നിരവധി ആസിഡുകൾ എന്നിവയുമായി യോജിക്കുന്നു, അവയിൽ ഏറ്റവും ലളിതമായത് ക്രോമിക് H 2 CrO 4, ഡിക്രോമിക് H 2 Cr 2 O 7 എന്നിവയാണ്. ആംഫോട്ടറിക് ഓക്സൈഡുകൾ ഉത്തരം: 3 വിശദീകരണം: ഉപ്പ് രൂപപ്പെടുന്ന ഓക്സൈഡുകളാണ് ആംഫോട്ടറിക് ഓക്സൈഡുകൾ, ഇത് വ്യവസ്ഥകളെ ആശ്രയിച്ച് അടിസ്ഥാന അല്ലെങ്കിൽ അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു (അതായത്, ആംഫോട്ടെറിസിറ്റി കാണിക്കുന്നു). സംക്രമണ ലോഹങ്ങളാൽ രൂപീകരിച്ചത്. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലെ ലോഹങ്ങൾ സാധാരണയായി +3 മുതൽ +4 വരെ ഓക്സീകരണ നില കാണിക്കുന്നു, ZnO, BeO, SnO, PbO എന്നിവ ഒഴികെ. ZnO ഒരു ആംഫോട്ടറിക് ഓക്സൈഡാണ്. N 2 O, NO, SiO, CO എന്നിവയാണ് ഉപ്പ് രൂപപ്പെടാത്ത ഓക്സൈഡുകൾ. +1, +2 എന്നിവയുടെ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ഇവയിൽ ഇവ ഉൾപ്പെടുന്നു: - ആദ്യത്തെ ഗ്രൂപ്പിലെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (ക്ഷാര ലോഹങ്ങൾ) Li - Fr (ഈ ഗ്രൂപ്പിൽ പൊട്ടാസ്യം ഓക്സൈഡ് K 2 O ഉൾപ്പെടുന്നു); - രണ്ടാമത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (Mg, ക്ഷാര എർത്ത് ലോഹങ്ങൾ) Mg - Ra; - താഴ്ന്ന ഓക്സിഡേഷൻ അവസ്ഥകളിലെ സംക്രമണ ലോഹങ്ങളുടെ ഓക്സൈഡുകൾ. ആസിഡ് ഓക്സൈഡുകൾ (അൺഹൈഡ്രൈഡുകൾ) ഓക്സൈഡുകളാണ്, ഇത് അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുകയും ഓക്സിജൻ അടങ്ങിയ ആസിഡുകൾ രൂപപ്പെടുത്തുകയും ചെയ്യുന്നു. സാധാരണ നോൺ-ലോഹങ്ങളും ചില സംക്രമണ ഘടകങ്ങളും ഉപയോഗിച്ച് രൂപപ്പെടുത്തി. അസിഡിക് ഓക്സൈഡുകളിലെ ഘടകങ്ങൾ സാധാരണയായി +4 മുതൽ +7 വരെ ഓക്സീകരണ അവസ്ഥ കാണിക്കുന്നു. അതിനാൽ, സൾഫ്യൂറിക് ആസിഡ് H 2 SO 4 ന് സമാനമായ ആസിഡ് ഓക്സൈഡാണ് SO 3. 7FDBA3ഇനിപ്പറയുന്നവയിൽ ഏതാണ് ശരി? ഉത്തരം. അടിസ്ഥാന ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. അടിസ്ഥാന ഓക്സൈഡുകൾ ലോഹങ്ങൾ മാത്രമാണ്. 1) A മാത്രം ശരിയാണ് 2) ബി മാത്രം ശരിയാണ് 3) രണ്ട് പ്രസ്താവനകളും ശരിയാണ് 4) രണ്ട് പ്രസ്താവനകളും തെറ്റാണ് ഉത്തരം: 3 വിശദീകരണം: +1, +2 എന്നിവയുടെ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ഇവയിൽ ഇവ ഉൾപ്പെടുന്നു: - ആദ്യത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ക്ഷാരഗുണത്തിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (ക്ഷാര ലോഹങ്ങൾ) Li - Fr; - രണ്ടാമത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (Mg, ക്ഷാര എർത്ത് ലോഹങ്ങൾ) Mg - Ra; - താഴ്ന്ന ഓക്സിഡേഷൻ അവസ്ഥകളിലെ സംക്രമണ ലോഹങ്ങളുടെ ഓക്സൈഡുകൾ. അടിസ്ഥാന ഓക്സൈഡുകൾ അടിസ്ഥാന ഓക്സൈഡുകളുമായി ഹൈഡ്രോക്സൈഡ് ആയി പൊരുത്തപ്പെടുന്നു. രണ്ട് പ്രസ്താവനകളും ശരിയാണ്. സാധാരണ അവസ്ഥയിൽ വെള്ളവുമായി പ്രതികരിക്കുന്നു. 1) നൈട്രിക് ഓക്സൈഡ് (II) 2) ഇരുമ്പ് ഓക്സൈഡ് (II) 3) ഇരുമ്പ് ഓക്സൈഡ് (III) ഉത്തരം: 4 വിശദീകരണം: നൈട്രിക് ഓക്സൈഡ് (II) NO എന്നത് ഉപ്പ് രൂപപ്പെടാത്ത ഓക്സൈഡാണ്, അതിനാൽ ഇത് വെള്ളവുമായോ അടിസ്ഥാനങ്ങളുമായോ പ്രതിപ്രവർത്തിക്കുന്നില്ല. അയൺ (II) ഓക്സൈഡ് വെള്ളത്തിൽ ലയിക്കാത്ത പ്രധാന ഓക്സൈഡ് FeO ആണ്. വെള്ളവുമായി പ്രതികരിക്കുന്നില്ല. അയൺ (III) ഓക്സൈഡ് വെള്ളത്തിൽ ലയിക്കാത്ത ഒരു ആംഫോട്ടറിക് ഓക്സൈഡാണ് Fe 2 O 3. ഇത് വെള്ളവുമായി പ്രതികരിക്കുന്നില്ല. നൈട്രിക് ഓക്സൈഡ് (IV) NO 2 ഒരു ആസിഡ് ഓക്സൈഡാണ്, ഇത് വെള്ളവുമായി പ്രതിപ്രവർത്തിച്ച് നൈട്രിക് (HNO 3; N +5), നൈട്രസ് (HNO 2; N +3) ആസിഡുകൾ: 2NO 2 + H 2 O \u003d HNO 3 + HNO 2 പദാർത്ഥങ്ങളുടെ പട്ടികയിൽ\u200c: ZnO, FeO, CrO 3, CaO, Al 2 O 3, Na 2 O, Cr 2 O 3 ഉത്തരം: 3 വിശദീകരണം: +1, +2 എന്നിവയുടെ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ഇവയിൽ ഇവ ഉൾപ്പെടുന്നു:
നിർദ്ദിഷ്ട ഓപ്ഷനുകളിൽ, അടിസ്ഥാന ഓക്സൈഡുകളുടെ ഗ്രൂപ്പിൽ FeO, CaO, Na 2 O. എന്നിവ ഉൾപ്പെടുന്നു. ഉപ്പ് രൂപപ്പെടുന്ന ഓക്സൈഡുകളാണ് ആംഫോട്ടറിക് ഓക്സൈഡുകൾ, ഇത് വ്യവസ്ഥകളെ ആശ്രയിച്ച് അടിസ്ഥാന അല്ലെങ്കിൽ അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു (അതായത്, ആംഫോട്ടെറിസിറ്റി കാണിക്കുന്നു). സംക്രമണ ലോഹങ്ങളാൽ രൂപീകരിച്ചത്. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലെ ലോഹങ്ങൾ സാധാരണയായി +3 മുതൽ +4 വരെ ഓക്സീകരണ നില കാണിക്കുന്നു, ZnO, BeO, SnO, PbO എന്നിവ ഒഴികെ. ZnO, Al 2 O 3, Cr 2 O 3 എന്നിവ ആംഫോട്ടറിക് ഓക്സൈഡുകളിൽ ഉൾപ്പെടുന്നു. ആസിഡ് ഓക്സൈഡുകൾ (അൺഹൈഡ്രൈഡുകൾ) ഓക്സൈഡുകളാണ്, ഇത് അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുകയും ഓക്സിജൻ അടങ്ങിയ ആസിഡുകൾ രൂപപ്പെടുത്തുകയും ചെയ്യുന്നു. സാധാരണ നോൺ-ലോഹങ്ങളും ചില സംക്രമണ ഘടകങ്ങളും ഉപയോഗിച്ച് രൂപപ്പെടുത്തി. അസിഡിക് ഓക്സൈഡുകളിലെ ഘടകങ്ങൾ സാധാരണയായി +4 മുതൽ +7 വരെ ഓക്സീകരണ അവസ്ഥ കാണിക്കുന്നു. അതിനാൽ, ക്രോമിക് ആസിഡ് H 2 CrO 4 ന് സമാനമായ ആസിഡ് ഓക്സൈഡാണ് CrO 3. 382482പൊട്ടാസ്യം ഓക്സൈഡ് സംവദിക്കുന്നു ഉത്തരം: 3 വിശദീകരണം: പൊട്ടാസ്യം ഓക്സൈഡ് (കെ 2 ഒ) അടിസ്ഥാന ഓക്സൈഡുകളെയാണ് സൂചിപ്പിക്കുന്നത്. ഒരു അടിസ്ഥാന ഓക്സൈഡ് എന്ന നിലയിൽ, K 2 O ന് ആംഫോട്ടറിക് ഓക്സൈഡുകളുമായി സംവദിക്കാൻ കഴിയും, കാരണം ഓക്സൈഡുകൾ അസിഡിറ്റി, ബേസിക് പ്രോപ്പർട്ടികൾ (ZnO) പ്രദർശിപ്പിക്കുന്നു. ZnO ഒരു ആംഫോട്ടറിക് ഓക്സൈഡാണ്. അടിസ്ഥാന ഓക്സൈഡുകളുമായി (CaO, MgO, Li 2 O) പ്രതിപ്രവർത്തിക്കുന്നില്ല. പ്രതികരണം ഇനിപ്പറയുന്ന രീതിയിൽ തുടരുന്നു: K 2 O + ZnO \u003d K 2 ZnO 2 +1, +2 എന്നിവയുടെ ഓക്സിഡേഷൻ അവസ്ഥകളിലെ മെറ്റൽ ഓക്സൈഡുകളാണ് അടിസ്ഥാന ഓക്സൈഡുകൾ. ഇവയിൽ ഇവ ഉൾപ്പെടുന്നു: - ആദ്യത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ക്ഷാരഗുണത്തിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (ക്ഷാര ലോഹങ്ങൾ) Li - Fr; - രണ്ടാമത്തെ ഗ്രൂപ്പിന്റെ പ്രധാന ഉപഗ്രൂപ്പിന്റെ മെറ്റൽ ഓക്സൈഡുകൾ (Mg, ക്ഷാര എർത്ത് ലോഹങ്ങൾ) Mg - Ra; - താഴ്ന്ന ഓക്സിഡേഷൻ അവസ്ഥകളിലെ സംക്രമണ ലോഹങ്ങളുടെ ഓക്സൈഡുകൾ. ഉപ്പ് രൂപപ്പെടുന്ന ഓക്സൈഡുകളാണ് ആംഫോട്ടറിക് ഓക്സൈഡുകൾ, ഇത് വ്യവസ്ഥകളെ ആശ്രയിച്ച് അടിസ്ഥാന അല്ലെങ്കിൽ അസിഡിറ്റി ഗുണങ്ങൾ പ്രകടിപ്പിക്കുന്നു (അതായത്, ആംഫോട്ടെറിസിറ്റി കാണിക്കുന്നു). സംക്രമണ ലോഹങ്ങളാൽ രൂപീകരിച്ചത്. ആംഫോട്ടറിക് ഓക്സൈഡുകളിലെ ലോഹങ്ങൾ സാധാരണയായി +3 മുതൽ +4 വരെ ഓക്സീകരണ നില കാണിക്കുന്നു, ZnO, BeO, SnO, PbO എന്നിവ ഒഴികെ. കൂടാതെ, ഉപ്പ് അല്ലാത്ത ഓക്സൈഡുകളായ N 2 O, NO, SiO, CO ഉണ്ട്. അസിഡിക്, ബേസിക് അല്ലെങ്കിൽ ആംഫോട്ടറിക് ഗുണങ്ങൾ പ്രകടിപ്പിക്കാത്ത ലവണങ്ങൾ ഉണ്ടാകാത്ത ഓക്സൈഡുകളാണ് ഉപ്പ് അല്ലാത്ത ഓക്സൈഡുകൾ. സിലിക്കൺ (IV) ഓക്സൈഡ് രണ്ട് വസ്തുക്കളുമായി പ്രതിപ്രവർത്തിക്കുന്നു 2) H 2 SO 4, BaCl 2 ഉത്തരം: 3 വിശദീകരണം: സിലിക്കൺ ഓക്സൈഡ് (SiO 2) ഒരു ആസിഡ് ഓക്സൈഡാണ്, അതിനാൽ ക്ഷാരങ്ങളുമായും അടിസ്ഥാന ഓക്സൈഡുകളുമായും സംവദിക്കുന്നു: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O. സൾഫറിനുള്ള +4 ഓക്\u200cസിഡേഷൻ നില വളരെ സ്ഥിരതയുള്ളതാണ്, ഇത് ഷാൽ 4 ടെട്രാഹാലൈഡുകൾ, എസ്\u200cഒ\u200cഎച്ച് 2 ഓക്\u200cസോ-ഡൈഹാലൈഡുകൾ, എസ്\u200cഒ 2 ഡയോക്സൈഡ്, അനുബന്ധ അയോണുകൾ എന്നിവയിൽ പ്രകടമാണ്. സൾഫർ ഡയോക്സൈഡിന്റെയും സൾഫർ ഡയോക്സൈഡിന്റെയും ഗുണങ്ങളെക്കുറിച്ച് നമുക്ക് പരിചയപ്പെടാം. 1.11.1. സൾഫർ ഓക്സൈഡ് (IV) സോ 2 തന്മാത്രയുടെ ഘടനSO 2 തന്മാത്രയുടെ ഘടന ഓസോൺ തന്മാത്രയുടെ ഘടനയ്ക്ക് സമാനമാണ്. സൾഫർ ആറ്റം sp 2 ഹൈബ്രിഡൈസേഷന്റെ അവസ്ഥയിലാണ്, ഭ്രമണപഥങ്ങളുടെ ആകൃതി ഒരു സാധാരണ ത്രികോണമാണ്, തന്മാത്രയുടെ ആകൃതി കോണാകൃതിയാണ്. സൾഫർ ആറ്റത്തിൽ ഒരു ഷെയർ ചെയ്യാത്ത ഇലക്ട്രോൺ ജോഡി ഉണ്ട്. S - O ബോണ്ട് നീളം 0.143 nm, വാലൻസ് ആംഗിൾ 119.5 is. ഘടന ഇനിപ്പറയുന്ന അനുരണന ഘടനകളുമായി യോജിക്കുന്നു: ഓസോണിൽ നിന്ന് വ്യത്യസ്തമായി, എസ് - ഒ ബോണ്ടിന്റെ ഗുണിതം 2 ആണ്, അതായത്, ആദ്യത്തെ അനുരണന ഘടന പ്രധാന സംഭാവന നൽകുന്നു. ഉയർന്ന താപ സ്ഥിരതയാണ് തന്മാത്രയുടെ സവിശേഷത. ഭൗതിക സവിശേഷതകൾസാധാരണ അവസ്ഥയിൽ, സൾഫർ ഡയോക്സൈഡ് അല്ലെങ്കിൽ സൾഫർ ഡയോക്സൈഡ് നിറമില്ലാത്ത വാതകമാണ്, മൂർച്ചയുള്ള ശ്വാസോച്ഛ്വാസം, ദ്രവണാങ്കം -75 ° C, ചുട്ടുതിളക്കുന്ന പോയിന്റ് -10 ° C. ഇത് വെള്ളത്തിൽ ലയിക്കുന്നു, 1 വോള്യത്തിൽ 20 ° C താപനിലയിൽ 40 വോളിയം സൾഫർ ഡൈ ഓക്സൈഡ് അലിഞ്ഞു പോകുന്നു. വിഷവാതകം. സൾഫർ ഓക്സൈഡിന്റെ (IV) രാസ ഗുണങ്ങൾസൾഫർ വാതകം വളരെ സജീവമാണ്. സൾഫർ ഡയോക്സൈഡ് ഒരു ആസിഡ് ഓക്സൈഡാണ്. ഹൈഡ്രേറ്റുകളുടെ രൂപവത്കരണത്തോടെ ഇത് വെള്ളത്തിൽ ലയിക്കുന്നു. ഇത് ഭാഗികമായി ജലവുമായി ഇടപഴകുകയും ദുർബലമായ സൾഫ്യൂറിക് ആസിഡ് രൂപപ്പെടുകയും ചെയ്യുന്നു, ഇത് വ്യക്തിഗത രൂപത്തിൽ ഒറ്റപ്പെടില്ല: SO 2 + H 2 O \u003d H 2 SO 3 \u003d H + + HSO 3 - \u003d 2H + + SO 3 2-. വിഘടനത്തിന്റെ ഫലമായി, പ്രോട്ടോണുകൾ രൂപം കൊള്ളുന്നു, അതിനാൽ പരിഹാരത്തിന് ഒരു അസിഡിക് അന്തരീക്ഷമുണ്ട്. സോഡിയം ഹൈഡ്രോക്സൈഡിന്റെ ഒരു ലായനിയിലൂടെ വാതക സൾഫർ ഡയോക്സൈഡ് കടന്നുപോകുമ്പോൾ, സോഡിയം സൾഫൈറ്റ് രൂപം കൊള്ളുന്നു. സോഡിയം സൾഫൈറ്റ് സൾഫർ ഡയോക്സൈഡിന്റെ അധികമായി പ്രതിപ്രവർത്തിക്കുകയും സോഡിയം ഹൈഡ്രോസൾഫൈറ്റ് രൂപപ്പെടുകയും ചെയ്യുന്നു: 2NaOH + SO 2 \u003d Na 2 SO 3 + H 2 O; Na 2 SO 3 + SO 2 \u003d 2NaHSO 3. സൾഫർ വാതകത്തിന്റെ സവിശേഷത റെഡോക്സ് ദ്വൈതമാണ്, ഉദാഹരണത്തിന്, ഇത് പ്രോപ്പർട്ടികൾ കുറയ്ക്കുന്നതായി കാണിക്കുമ്പോൾ, ഇത് ബ്രോമിൻ ജലത്തെ വിസർജ്ജിക്കുന്നു: SO 2 + Br 2 + 2H 2 O \u003d H 2 SO 4 + 2HBr പൊട്ടാസ്യം പെർമാങ്കനേറ്റ് ലായനി: 5SO 2 + 2KMnO 4 + 2H 2 O \u003d 2KHSO 4 + 2MnSO 4 + H 2 SO 4. ഓക്സിജൻ ഉപയോഗിച്ച് ഓക്സീകരിക്കപ്പെട്ട സൾഫ്യൂറിക് അൺഹൈഡ്രൈഡ്: 2SO 2 + O 2 \u003d 2SO 3. ശക്തമായ കുറയ്ക്കുന്ന ഏജന്റുമാരുമായി ഇടപഴകുമ്പോൾ ഇത് ഓക്സിഡൈസിംഗ് സവിശേഷതകൾ പ്രദർശിപ്പിക്കുന്നു, ഉദാഹരണത്തിന്: SO 2 + 2CO \u003d S + 2CO 2 (500 ° C ന്, അൽ 2 O 3 ന്റെ സാന്നിധ്യത്തിൽ); SO 2 + 2H 2 \u003d S + 2H 2 O. സൾഫർ ഓക്സൈഡ് (IV) തയ്യാറാക്കൽസൾഫർ വായുവിൽ കത്തുന്നു S + O 2 \u003d SO 2. സൾഫൈഡ് ഓക്സീകരണം 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2. ലോഹ സൾഫൈറ്റുകളിൽ ശക്തമായ ആസിഡുകളുടെ പ്രഭാവം Na 2 SO 3 + 2H 2 SO 4 \u003d 2NaHSO 4 + H 2 O + SO 2. 1.11.2. സൾഫ്യൂറിക് ആസിഡും അതിന്റെ ലവണങ്ങളുംസൾഫർ ഡയോക്സൈഡ് വെള്ളത്തിൽ ലയിക്കുമ്പോൾ, ദുർബലമായ സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു, അലിഞ്ഞുപോയ SO 2 ന്റെ ഭൂരിഭാഗവും SO 2 · H 2 O ന്റെ ജലാംശം രൂപത്തിലാണ്, ക്രിസ്റ്റലിൻ ഹൈഡ്രേറ്റും തണുപ്പിക്കൽ സമയത്ത് പുറത്തുവിടുന്നു, സൾഫ്യൂറിക് ആസിഡ് തന്മാത്രകളുടെ ഒരു ചെറിയ ഭാഗം മാത്രമേ സൾഫൈറ്റ്, ഹൈഡ്രോസൾഫൈറ്റ് അയോണുകളായി വിഘടിക്കുന്നുള്ളൂ. സ്വതന്ത്ര അവസ്ഥയിൽ, ആസിഡ് വേർതിരിക്കപ്പെടുന്നില്ല. ഡൈബാസിക് ആയതിനാൽ ഇത് രണ്ട് തരം ലവണങ്ങൾ ഉണ്ടാക്കുന്നു: ഇടത്തരം - സൾഫൈറ്റുകൾ, ആസിഡ് - ഹൈഡ്രോസൾഫൈറ്റുകൾ. ക്ഷാര ലോഹ സൾഫൈറ്റുകളും ക്ഷാര, ക്ഷാര-ഭൗമ ലോഹങ്ങളുടെ ഹൈഡ്രോസൾഫൈറ്റുകളും മാത്രമേ വെള്ളത്തിൽ ലയിക്കുന്നുള്ളൂ. സൾഫർ ഓക്സൈഡ് (സൾഫർ ഡയോക്സൈഡ്, സൾഫർ ഡയോക്സൈഡ്, സൾഫർ ഡയോക്സൈഡ്) നിറമില്ലാത്ത വാതകമാണ്, ഇത് സാധാരണ അവസ്ഥയിൽ മൂർച്ചയുള്ള സ്വഭാവഗുണമുള്ള (കത്തുന്ന പൊരുത്തത്തിന്റെ ഗന്ധത്തിന് സമാനമാണ്). ഇത് room ഷ്മാവിൽ സമ്മർദ്ദത്തിൽ ദ്രവീകരിക്കുന്നു. സൾഫർ വാതകം വെള്ളത്തിൽ ലയിക്കുന്നു, അസ്ഥിരമായ സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു. കൂടാതെ, ഈ പദാർത്ഥം സൾഫ്യൂറിക് ആസിഡ്, എത്തനോൾ എന്നിവയിൽ ലയിക്കുന്നു. അഗ്നിപർവ്വത വാതകങ്ങൾ നിർമ്മിക്കുന്ന പ്രധാന ഘടകങ്ങളിൽ ഒന്നാണിത്. സൾഫറസ് വാതകം വ്യാവസായിക രീതിയിൽ SO2 - സൾഫർ ഡയോക്സൈഡ് ലഭിക്കുന്നത് സൾഫർ കത്തുന്നതോ സൾഫൈഡുകൾ കത്തുന്നതോ ആണ് (പ്രധാനമായും പൈറൈറ്റ് ഉപയോഗിക്കുന്നു). 4FeS2 (പൈറൈറ്റ്) + 11O2 \u003d 2Fe2O3 + 8SO2 (സൾഫർ ഡയോക്സൈഡ്). ലബോറട്ടറി സാഹചര്യങ്ങളിൽ, ഹൈഡ്രോസൾഫൈറ്റുകളിലേക്കും സൾഫൈറ്റുകളിലേക്കും ശക്തമായ ആസിഡുകൾ തുറന്നുകാണിക്കുന്നതിലൂടെ സൾഫറസ് വാതകം ലഭിക്കും. ഈ സാഹചര്യത്തിൽ, തത്ഫലമായുണ്ടാകുന്ന സൾഫ്യൂറിക് ആസിഡ് ഉടൻ തന്നെ വെള്ളത്തിലേക്കും സൾഫർ ഡയോക്സൈഡിലേക്കും വിഘടിക്കുന്നു. ഉദാഹരണത്തിന്: Na2SO3 + H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) \u003d Na2SO4 + H2SO3 (സൾഫ്യൂറിക് ആസിഡ്). കുറഞ്ഞ സജീവ ലോഹങ്ങളിൽ ചൂടാക്കുമ്പോൾ സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡിന്റെ പ്രവർത്തനമാണ് സൾഫർ ഡയോക്സൈഡ് ഉത്പാദിപ്പിക്കുന്നതിനുള്ള മൂന്നാമത്തെ രീതി. ഉദാഹരണത്തിന്: Cu (ചെമ്പ്) + 2H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) \u003d CuSO4 (കോപ്പർ സൾഫേറ്റ്) + SO2 (സൾഫർ ഡയോക്സൈഡ്) + 2H2O (വെള്ളം). സൾഫർ ഡയോക്സൈഡിന്റെ രാസ ഗുണങ്ങൾ SO3 ആണ് സൾഫർ ഡയോക്സൈഡ് ഫോർമുല. ഈ പദാർത്ഥം ആസിഡ് ഓക്സൈഡുകളുടേതാണ്. 1. സൾഫർ ഡൈ ഓക്സൈഡ് വെള്ളത്തിൽ ലയിക്കുന്നു, സൾഫ്യൂറിക് ആസിഡ് രൂപം കൊള്ളുന്നു. സാധാരണ അവസ്ഥയിൽ, ഈ പ്രതികരണം പഴയപടിയാക്കാനാകും. SO2 (സൾഫർ ഡയോക്സൈഡ്) + H2O (വെള്ളം) \u003d H2SO3 (സൾഫ്യൂറസ് ആസിഡ്). 2. ക്ഷാരത്തോടൊപ്പം സൾഫർ ഡയോക്സൈഡ് സൾഫൈറ്റുകളായി മാറുന്നു. ഉദാഹരണത്തിന്: 2NaOH (സോഡിയം ഹൈഡ്രോക്സൈഡ്) + SO2 (സൾഫർ ഡയോക്സൈഡ്) \u003d Na2SO3 (സോഡിയം സൾഫൈറ്റ്) + H2O (വെള്ളം). 3. സൾഫർ ഡൈ ഓക്സൈഡിന്റെ രാസപ്രവർത്തനം വളരെ വലുതാണ്. സൾഫർ ഡയോക്സൈഡിന്റെ ഏറ്റവും കൂടുതൽ കുറയ്ക്കുന്ന ഗുണങ്ങൾ. അത്തരം പ്രതിപ്രവർത്തനങ്ങളിൽ സൾഫറിന്റെ ഓക്സീകരണത്തിന്റെ അളവ് വർദ്ധിക്കുന്നു. ഉദാഹരണത്തിന്: 1) SO2 (സൾഫർ ഡയോക്സൈഡ്) + Br2 (ബ്രോമിൻ) + 2H2O (വെള്ളം) \u003d H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) + 2HBr (ഹൈഡ്രജൻ ബ്രോമൈഡ്); 2) 2SO2 (സൾഫർ ഡയോക്സൈഡ്) + O2 (ഓക്സിജൻ) \u003d 2SO3 (സൾഫൈറ്റ്); 3) 5SO2 (സൾഫർ ഡയോക്സൈഡ്) + 2KMnO4 (പൊട്ടാസ്യം പെർമാങ്കനേറ്റ്) + 2H2O (വെള്ളം) \u003d 2H2SO4 (സൾഫ്യൂറിക് ആസിഡ്) + 2MnSO4 (മാംഗനീസ് സൾഫേറ്റ്) + K2SO4 (പൊട്ടാസ്യം സൾഫേറ്റ്). SO2, SO3 എന്നിവയ്ക്കുള്ള ഗുണപരമായ പ്രതികരണത്തിന്റെ ഉദാഹരണമാണ് രണ്ടാമത്തെ പ്രതികരണം. വയലറ്റ് ലായനിയിലെ നിറം മാറുന്നു). 4. ശക്തമായ കുറയ്ക്കുന്ന ഏജന്റുകളുടെ സാന്നിധ്യത്തിൽ, സൾഫറസ് ആൻ\u200cഹൈഡ്രൈഡ് ഓക്സിഡൈസിംഗ് ഗുണങ്ങൾ പ്രകടിപ്പിച്ചേക്കാം. ഉദാഹരണത്തിന്, മെറ്റലർജിക്കൽ വ്യവസായത്തിലെ മാലിന്യ വാതകങ്ങളിൽ നിന്ന് സൾഫർ വേർതിരിച്ചെടുക്കുന്നതിന്, കാർബൺ മോണോക്സൈഡ് (CO) ഉപയോഗിച്ച് സൾഫർ ഡയോക്സൈഡ് കുറയ്ക്കുന്നത് ഉപയോഗിക്കുന്നു: SO2 (സൾഫർ ഡയോക്സൈഡ്) + 2CO (കാർബൺ മോണോക്സൈഡ്) \u003d 2CO2 + S (സൾഫർ). ഫോസ്ഫറസ് ആസിഡ് ലഭിക്കുന്നതിന് ഈ പദാർത്ഥത്തിന്റെ ഓക്സിഡൈസിംഗ് ഗുണങ്ങളും ഉപയോഗിക്കുന്നു: PH3 (ഫോസ്ഫൈൻ) + SO2 (സൾഫർ ഡയോക്സൈഡ്) \u003d H3PO2 (ഫോസ്ഫോറിക് ആസിഡ്) + S (സൾഫർ). സൾഫറസ് വാതകം എവിടെയാണ് ഉപയോഗിക്കുന്നത്? സൾഫർ ഡയോക്സൈഡ് പ്രധാനമായും സൾഫ്യൂറിക് ആസിഡ് ഉത്പാദിപ്പിക്കാൻ ഉപയോഗിക്കുന്നു. കുറഞ്ഞ മദ്യപാനികളുടെ (വൈൻ, മിഡിൽ പ്രൈസ് വിഭാഗത്തിലെ മറ്റ് പാനീയങ്ങൾ) ഉൽ\u200cപാദനത്തിലും ഇത് ഉപയോഗിക്കുന്നു. വിവിധ സൂക്ഷ്മാണുക്കളെ കൊല്ലാനുള്ള ഈ വാതകത്തിന്റെ സ്വത്ത് കാരണം, അവ സംഭരണ \u200b\u200bസൗകര്യങ്ങളും പച്ചക്കറി സ്റ്റോറുകളും ഉപയോഗിച്ച് നശിപ്പിക്കപ്പെടുന്നു. കൂടാതെ, കമ്പിളി, പട്ട്, വൈക്കോൽ (ക്ലോറിൻ ഉപയോഗിച്ച് ബ്ലീച്ച് ചെയ്യാൻ കഴിയാത്ത വസ്തുക്കൾ) ബ്ലീച്ച് ചെയ്യാൻ സൾഫർ ഓക്സൈഡ് ഉപയോഗിക്കുന്നു. ലബോറട്ടറികളിൽ സൾഫർ ഡയോക്സൈഡ് ഒരു ലായകമായും സൾഫർ ഡയോക്സൈഡിന്റെ വിവിധ ലവണങ്ങൾ ലഭിക്കുന്നതിനും ഉപയോഗിക്കുന്നു. ഫിസിയോളജിക്കൽ ഇഫക്റ്റുകൾ സൾഫർ വാതകത്തിന് ശക്തമായ വിഷഗുണങ്ങളുണ്ട്. ചുമ, മൂക്കൊലിപ്പ്, പരുക്കൻ സ്വഭാവം, വായിൽ വിചിത്രമായ രുചി, തൊണ്ടവേദന എന്നിവ വിഷത്തിന്റെ ലക്ഷണങ്ങളാണ്. ഉയർന്ന സാന്ദ്രതയിൽ സൾഫർ ഡയോക്സൈഡ് ശ്വസിക്കുമ്പോൾ, വിഴുങ്ങാനും ശ്വാസംമുട്ടാനും ബുദ്ധിമുട്ട്, സംസാരശേഷി, ഓക്കാനം, ഛർദ്ദി എന്നിവ ഉണ്ടാകുമ്പോൾ അക്യൂട്ട് പൾമണറി എഡിമ ഉണ്ടാകാം. സൾഫർ ഡയോക്സൈഡിന്റെ MAC: വ്യക്തികളിലും സസ്യങ്ങളിലും മൃഗങ്ങളിലും സൾഫർ ഡൈ ഓക്സൈഡിനുള്ള സംവേദനക്ഷമത വ്യത്യസ്തമാണ്. ഉദാഹരണത്തിന്, മരങ്ങൾക്കിടയിൽ, ഏറ്റവും സ്ഥിരതയുള്ളത് ഓക്ക്, ബിർച്ച് എന്നിവയാണ്, ഏറ്റവും കുറഞ്ഞത് - കൂൺ, പൈൻ എന്നിവയാണ്. |
ജനപ്രിയമായത്:
പുതിയത്
- മെറ്റൽ ഘടനകളുടെ ഇൻസ്റ്റാളേഷൻ ചെലവ്
- ഒരു കവർച്ച അലാറത്തിനായി ബജറ്റ് ചെയ്യുന്നതിന്റെ ഉദാഹരണം ഒരു ഫയർ അലാറത്തിനായി എങ്ങനെ ബജറ്റ് ചെയ്യാം
- കമ്മീഷനിംഗ്: ഓർഗനൈസേഷൻ, നടപ്പാക്കൽ, പ്രോഗ്രാം, കമ്മീഷൻ ചെയ്യുന്നതിനുള്ള ചെലവ്
- എഞ്ചിനീയറിംഗ് സിസ്റ്റങ്ങൾക്കായുള്ള ഓട്ടോമേറ്റഡ് കൺട്രോൾ യൂണിറ്റുകൾ: ചൂടാക്കാനായി ഓട്ടോമേറ്റഡ് കൺട്രോൾ യൂണിറ്റുകളുടെ എംകെഡി സ്കീമുകളുടെ ഒരു ഓവർഹോൾ ആസൂത്രണം ചെയ്യുമ്പോൾ നിങ്ങൾ അറിയേണ്ടത്
- ബീജസങ്കലനത്തിലൂടെ തകർന്ന കല്ല് പാളികളുടെ നിർമ്മാണം
- തോടുകളുടെ മതിലുകൾ ഉറപ്പിക്കുന്നു ട്രെഞ്ചിന്റെ മതിലുകൾ ഉറപ്പിക്കുന്നതിനുള്ള പ്ലാസ്റ്റിക് പരിചകൾ
- സുഷിരങ്ങളുള്ള പ്ലാസ്റ്റർ കോർണർ എങ്ങനെ ഉപയോഗിക്കാം പ്ലാസ്റ്റേർഡ് കോണുകളിൽ സുഷിരമുള്ള കോണുകൾ ഇൻസ്റ്റാൾ ചെയ്യുന്നു
- ഗ്യാസ് പരവതാനിയുടെ ഉദ്ദേശ്യം ഗ്യാസ് പൈപ്പ്ലൈൻ ഡ്രോയിംഗിൽ ഒരു പരവതാനി സ്ഥാപിക്കൽ
- പരവതാനി പന്നി-ഇരുമ്പ് വെള്ളം KCHV-V (D400) ഉപകരണങ്ങളുടെ ഉദ്ദേശ്യവും പരവതാനികളുടെ ഇൻസ്റ്റാളേഷനും
- ഒരു ഫയർ അലാറം ഇൻസ്റ്റാൾ ചെയ്യുന്നതിനുള്ള ശരിയായ എസ്റ്റിമേറ്റ് ഞങ്ങൾ തയ്യാറാക്കുന്നു