1
/
5
Bununla birlikte, değerlik fenomeninin doğru ve daha sonra tamamen doğrulanmış bir anlayışı, 1852'de kimyager Edward Frankland tarafından, bu konuda o sırada var olan tüm teorileri ve varsayımları topladığı ve yeniden düşündüğü bir çalışmada önerildi. Farklı metalleri doyurma yeteneğinin gözlemlenmesi ve metallerin organik türevlerinin bileşiminin bileşimi ile karşılaştırılması. organik bileşikler Frankland, " bağlantı kuvveti» ( bağlantı ağırlığı), böylece değerlik doktrini için temel atma. Frankland bazı özel yasalar koymuş olsa da, fikirleri geliştirilmemiştir.
Değerlik teorisinin yaratılmasında belirleyici rol Friedrich August Kukule tarafından oynandı. 1857'de karbonun dört temel (dört atomlu) bir element olduğunu ve en basit bileşiğinin metan CH4 olduğunu gösterdi. Atomların değerliliği hakkındaki fikirlerinin doğruluğuna güvenen Kekule, onları organik kimya ders kitabına soktu: yazara göre baziklik, bir atomun temel bir özelliğidir, atom ağırlığı kadar sabit ve değişmez bir özelliktir. 1858 yılında Kekule'nin fikirleriyle neredeyse örtüşen görüşler “ Yeni kimyasal teori üzerine» Archibald Scott Cooper .
Üç yıl sonra, Eylül 1861'de A. M. Butlerov, değerlik teorisine en önemli eklemeleri yaptı. O, serbest bir atom ile afinitesi "olduğunda bir başkasıyla bağlantıya giren bir atom arasında net bir ayrım yaptı. bağlanır ve gider yeni form
". Butlerov, yakınlık kuvvetlerinin kullanımının eksiksizliği ve " afinite gerilimi”, yani, bir moleküldeki atomların karşılıklı etkisinden kaynaklanan, bağların enerji denkliği. Bu karşılıklı etki sonucunda atomlar, yapısal çevrelerine bağlı olarak farklı özellikler kazanırlar. "kimyasal önemi". Butlerov'un teorisi, organik bileşiklerin izomerizmi ve bunların reaktivitesi ile ilgili birçok deneysel gerçeği açıklamayı mümkün kıldı.
Değerlik teorisinin büyük bir avantajı, molekülün görsel bir temsili olasılığıydı. 1860'larda ilk moleküler modeller ortaya çıktı. Zaten 1864'te A. Brown, atomlar arasındaki kimyasal bağı gösteren çizgilerle birbirine bağlanan, içlerinde elementlerin sembollerinin yer aldığı daireler şeklinde yapısal formüllerin kullanılmasını önerdi; satır sayısı atomun değerliliğine karşılık geliyordu. 1865'te A. von Hoffmann, kroket toplarının atom rolünü oynadığı ilk top ve sopa modellerini gösterdi. 1866'da, Kekule'nin ders kitabında karbon atomunun tetrahedral bir konfigürasyona sahip olduğu stereokimyasal modellerin çizimleri ortaya çıktı.
Başlangıçta, değerlik birimi olarak hidrojen atomunun değerliliği alındı. Bu durumda başka bir elementin değeri, kendisine bağlanan veya bu diğer elementin bir atomunun yerini alan hidrojen atomlarının sayısı ile ifade edilebilir. Bu şekilde belirlenen değerlik, hidrojen bileşiklerinde değerlik veya hidrojen değerliliği olarak adlandırılır: örneğin, HCl, H20, NH3, CH4 bileşiklerinde, klorun hidrojen değerliliği bir, oksijen ikidir, azot üçtür, karbon dörttür.
Oksijenin değeri genellikle ikidir. Bu nedenle, belirli bir elementin oksijen bileşiğinin bileşimini veya formülünü bilerek, değerini bu elementin bir atomunun ekleyebileceği oksijen atomlarının sayısının iki katı olarak belirlemek mümkündür. Bu şekilde belirlenen değerlik, oksijen bileşiklerinde elementin değerliliği veya oksijenin değerliliği olarak adlandırılır: örneğin, K2O, CO, N203, Si02, S03 bileşiklerinde, potasyum oksijenin değerliliği bir, karbon - iki, nitrojen - üç, silikon - dört, kükürt - altı.
Çoğu element için hidrojen ve oksijen bileşiklerindeki değerlik değerleri farklıdır: örneğin, kükürtün hidrojendeki değerliliği iki (H 2 S) ve oksijende altıdır (SO 3). Ek olarak, çoğu element çeşitli bileşiklerinde farklı değerler sergiler [bazı elementler ne hidritlere ne de oksitlere sahip olabilir]. Örneğin, karbon oksijenle iki oksit oluşturur: karbon monoksit CO ve karbon dioksit CO2. Karbon monoksitte karbonun değeri ikidir ve dioksitte dörttür (bazı elementler ayrıca peroksitler de oluşturabilir). Ele alınan örneklerden, kural olarak, bir elemanın değerini herhangi bir sayı ve / veya yöntemle karakterize etmenin imkansız olduğu anlaşılmaktadır.
Değerlik hakkında modern fikirler
Kimyasal bağ teorisinin ortaya çıkışından bu yana, "değerlik" kavramı önemli bir evrim geçirdi. Şu anda, katı bir bilimsel yorumu yoktur, bu nedenle bilimsel kelime dağarcığından neredeyse tamamen çıkarılmıştır ve esas olarak metodolojik amaçlar için kullanılmaktadır.
Temel olarak, kimyasal elementlerin değeri genellikle serbest atomlarının (daha dar anlamda - yeteneğinin bir ölçüsü) belirli bir sayı oluşturma yeteneği olarak anlaşılır. kovalent bağlar. Kovalent bağlı bileşiklerde, atomların değerliliği, oluşan iki elektronlu iki merkezli bağların sayısı ile belirlenir. 1927'de W. Heitler ve F. London tarafından önerilen yerel değerlik bağları teorisinde benimsenen bu yaklaşımdır. Açıkçası, eğer bir atom varsa n eşleşmemiş elektronlar ve m yalnız elektron çiftleri, o zaman bu atom oluşturabilir n+m diğer atomlarla kovalent bağlar. Maksimum değeri değerlendirirken, sözde varsayımsal bir elektronik konfigürasyondan devam edilmelidir. "heyecanlı" (değerlik) durumu. Örneğin, bir bor, karbon ve nitrojen atomunun maksimum değeri 4'tür (örneğin, -, CH 4 ve + olarak), fosfor - 5 (PCl 5), kükürt - 6 (H2S04), klor - 7 (Cl207).
Bir atomun oluşturabileceği bağ sayısı, ortak elektron çiftlerini (moleküler iki elektronlu bulutlar) oluşturacak eşleşmemiş elektronlarının sayısına eşittir. Verici-alıcı mekanizma ile bir kovalent bağ da oluşturulabilir. Her iki durumda da, oluşan bağların polaritesi dikkate alınmaz ve bu nedenle değerlik işareti yoktur - ne pozitif ne de negatif olabilir, oksidasyon derecesinin aksine(N 2, NO 2, NH3 ve +).
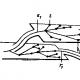
Hidrojen ve oksijendeki değerliliğe ek olarak, belirli bir elementin atomlarının birbirleriyle veya bazı durumlarda diğer elementlerin atomlarıyla birleşme yeteneği, başka şekillerde ifade edilebilir: örneğin, bir elementin oksidasyon derecesi (maddenin iyonlardan oluştuğu varsayımıyla bir atomun koşullu yükü), kovalans (aynı isimdeki element de dahil olmak üzere belirli bir elementin bir atomunun oluşturduğu kimyasal bağların sayısı); aşağıya bakınız), bir atomun koordinasyon sayısı (belirli bir atomu hemen çevreleyen atomların sayısı), vb. Bu özellikler birbirine yakın olabilir ve hatta nicel olarak çakışabilir, ancak hiçbir şekilde birbiriyle aynı olmayabilir. Örneğin, nitrojen N2 izoelektronik moleküllerinde, karbon monoksit CO ve siyanür iyonu CN - üçlü bir bağ gerçekleştirilir (yani, her atomun değeri 3'tür), ancak elementlerin oksidasyon durumu sırasıyla, 0, +2, -2, +2 ve -3. Etan molekülünde (şekle bakınız), karbon çoğu organik bileşikte olduğu gibi dört değerlidir, oksidasyon durumu ise -3'tür.
Bu özellikle delokalize kimyasal bağlara sahip moleküller için geçerlidir, örneğin, nitrik asitte, nitrojenin oksidasyon durumu +5'tir, nitrojen ise 4'ten yüksek bir değere sahip olamaz. okul ders kitapları kural - "Maksimum değerlik eleman sayısal olarak Periyodik Tablodaki grup numarasına eşittir" - yalnızca oksidasyon durumunu ifade eder. "Kalıcı değerlik" ve "değişken değerlik" terimleri de ağırlıklı olarak oksidasyon durumuna atıfta bulunur.
kovalentlik eleman (elemanların değerlik olasılıklarının bir ölçüsü; doyma kapasitesi) belirlenir toplam sayısı atomun hem normal hem de uyarılmış durumundaki eşleşmemiş elektronlar [değerlik elektron çiftleri] veya başka bir deyişle, atomun oluşturduğu kovalent bağ sayısı (karbon 2s 2 2p 2 II kovalenttir ve uyarılmış durumda C * 2s 1 2p 3 - IV -kovalent; dolayısıyla CO ve CO2'de değerlik II'dir veya IV ve kovalans - II ve/veya IV). Böylece, N2 , NH3 , Al≡N ve siyanamid Ca=N-C≡N moleküllerindeki azotun kovalansı üç, H2O ve CO2 moleküllerindeki oksijenin kovalansı iki, karbonun kovalansı ikidir. moleküller CH 4 , CO2 ve kristal ( elmas) - dört.
Klasik ve/veya kuantum sonrası kimyasal gösterimde, belirli bir uyarım enerjisindeki optik (değerlik) elektronların sayısı, iki atomlu moleküllerin elektronik absorpsiyon spektrumlarından belirlenebilir. Bu yönteme göre doğru/düz doğru korelasyonunun eğiminin tanjantının karşılığı (atomik terimlerin nispi toplamlarından oluşan moleküler elektronik terimlerin ilgili değerleri için) çift sayısına karşılık gelir. değerlik elektronları, yani klasik anlamda değerlik.
değerlik [stoikiometrik] arasında bu bileşik, atomlarının molar kütlesi ve eşdeğer kütlesi arasında, doğrudan atom teorisinden ve "eşdeğer kütle" kavramının tanımından gelen basit bir ilişki vardır.CO - değerlik, inorganik maddelerin çoğu moleküler olmayan bir yapıya sahip olduğundan ve organik maddeler moleküler bir yapıya sahiptir. Sayısal olarak örtüşseler bile bu iki kavramı tanımlamak imkansızdır. "Değerlik elektronları" terimi de yaygın olarak kullanılmaktadır, yani bir atomun çekirdeğiyle, çoğu zaman dış elektronlarla en zayıf şekilde ilişkilidir.
Elementlerin değerliklerine göre, bileşiklerin gerçek formülleri derlenebilir ve bunun tersine, gerçek formüllere dayanarak bu bileşiklerdeki elementlerin değerlerinin belirlenmesi mümkündür. Aynı zamanda, şu ilkeye bağlı kalmak gerekir: bir elementin değerlik değeri ile atom sayısının çarpımı, ikinci elementin değerlik değerinin atom sayısı ile ürününe eşittir. Bu nedenle, nitrik oksit (III) formülünü oluşturabilmek için elementlerin değerlik sembolünün üstüne yazılmalıdır. N I I I (\displaystyle (\stackrel (III)(\mbox(N)))) O I I (\displaystyle (\stackrel (II)(\mbox(O)))). En küçüğünü belirledikten sonra ortak payda ve onu karşılık gelen değerlere bölerek, nitrojenin oksijene atomik oranını, yani 2: 3'ü elde ederiz. Bu nedenle, oksit azot (III) formülü şuna karşılık gelir: N + 3 2 O − 2 3 (\displaystyle (\stackrel (+3)(\mbox(N)))_(2)(\stackrel (-2)(\mbox(O)))_(3)). Değerliği belirlemek için aynı işlemi tersten yapın.
Kimyasal formül, bir kimyasal bileşiğin veya basit bir maddenin bileşimini (yapısını) yansıtır. Örneğin, H20 - iki hidrojen atomu bir oksijen atomuna bağlanır. Kimyasal formüller ayrıca maddenin yapısı hakkında bazı bilgiler içerir: örneğin, Fe (OH) 3, Al 2 (SO 4) 3 - bu formüller, maddeyi oluşturan bazı kararlı grupları (OH, SO 4) - molekülünü gösterir. , formül veya yapısal birim (PU veya SU).
Moleküler formül moleküldeki her bir elementin atom sayısını gösterir. Moleküler formül sadece moleküler yapıya sahip maddeleri (gazlar, sıvılar ve bazı katılar) tanımlar. Atomik veya iyonik yapıya sahip bir maddenin bileşimi sadece formül birimlerinin sembolleri ile tanımlanabilir.
formül birimleri atom sayısı arasındaki en basit ilişkiyi gösterir. farklı unsurlarözünde. Örneğin, benzenin formül birimi CH'dir, moleküler formül C6H6'dır.
Yapısal (grafik) formül bir moleküldeki (FE ve CE'de olduğu gibi) atomların bağlantı sırasını ve atomlar arasındaki bağların sayısını gösterir.
Bu tür formüllerin dikkate alınması fikrine yol açtı. değerlik(valentia - güç) - belirli bir elementin atomunun belirli sayıda başka atomu kendisine bağlama kabiliyetine ne dersiniz? Üç tür değerlik ayırt edilebilir: stokiyometrik (oksidasyon derecesi dahil), yapısal ve elektronik.
Stokiyometrik değerlik. Değerlik tanımına nicel bir yaklaşım, "eşdeğer" kavramının kurulmasından ve eşdeğerler yasasına göre tanımlanmasından sonra mümkün olmuştur. Bu kavramlara dayanarak, kişi kavramı tanıtılabilir. stokiyometrik değerlik belirli bir atomun kendisine ekleyebileceği eşdeğerlerin sayısı veya atomdaki eşdeğerlerin sayısıdır. Eşdeğerler hidrojen atomlarının sayısı ile belirlenir, daha sonra V stx aslında bu atomun etkileşime girdiği hidrojen atomlarının (veya eşdeğer parçacıkların) sayısı anlamına gelir.
V stx \u003d Z B veya V stx \u003d. (1.1)
Örneğin, SO 3'te ( S= +6), Z B (S), 6 V stx (S) = 6'ya eşittir.
Hidrojen eşdeğeri 1'dir, dolayısıyla aşağıdaki bileşiklerdeki elementler için Z B (Cl) = 1, Z B (O) = 2, Z B (N) = 3 ve Z B (C) = 4. Sayısal değer stokiyometrik değerlik genellikle Romen rakamlarıyla gösterilir:
I I I II III I IV I
HCl, H20, NH3, CH4.
Elementin hidrojen ile birleşmediği durumlarda, istenen elementin değerliliği, değerliliği bilinen element tarafından belirlenir. Çoğu zaman, oksijen tarafından bulunur, çünkü bileşiklerdeki değeri genellikle ikiye eşittir. Örneğin, bağlantılarda:
II II III II IV II
CaO Al 2 O 3 CO 2 .
Bir ikili bileşiğin formülünü kullanarak bir elementin stokiyometrik değerini belirlerken, bir elementin tüm atomlarının toplam değerinin, başka bir elementin tüm atomlarının toplam değerine eşit olması gerektiği unutulmamalıdır.
Elementlerin değerliklerini bilerek, bir maddenin kimyasal formülünü oluşturmak mümkündür. Kimyasal formülleri derlerken aşağıdaki prosedürü takip edebilirsiniz:
1. Bileşiği oluşturan elementlerin kimyasal sembollerinin yanına KO AlCl AlO;
2. Kimyasal elementlerin sembollerinin üstüne değerliklerini yazınız:
I II III I III II
3. Yukarıdaki kuralı kullanarak, her iki elemanın (sırasıyla 2, 3 ve 6) stokiyometrik değerini ifade eden sayıların en küçük ortak katını belirleyin.
En küçük ortak kat, karşılık gelen elemanın değerliliğine bölünerek, indeksler bulunur:
I II III I III II
K 2 O AlCl 3 Al 2 O 3 .
örnek 1İçindeki klorun heptavalent ve oksijenin iki değerli olduğunu bilerek klor oksit formülünü yazın.
Karar. 2 ve 7 sayılarının en küçük katını buluyoruz - 14'e eşittir. En küçük ortak katı karşılık gelen elementin stokiyometrik değerine bölerek indeksleri buluyoruz: klor atomları için 14/7 = 2, oksijen atomları için 14 /2 = 7.
Oksit formülü -Cl207'dir.
Paslanma durumu ayrıca maddenin bileşimini de karakterize eder ve artı işareti (bir metal veya bir moleküldeki daha elektropozitif bir element için) veya eksi işareti ile stokiyometrik değere eşittir.
= ±V stx. (1.2)
w, V stx aracılığıyla, dolayısıyla eşdeğer aracılığıyla tanımlanır ve bu, w(H) = ±1 olduğu anlamına gelir; ayrıca, çeşitli bileşiklerdeki diğer tüm elementlerin w'si ampirik olarak bulunabilir. Özellikle, bir dizi elementin her zaman veya hemen hemen her zaman sabit oksidasyon durumlarına sahip olması önemlidir.
Oksidasyon durumlarını belirlemek için aşağıdaki kuralları hatırlamakta fayda var.
1. w(H) = ±1 (. w = +1 içinde H20, HCl; .w = –1 NaH, CaH2 içinde);
2.
F(flor) tüm bileşiklerde w = -1'e sahiptir, diğer metalli halojenler, hidrojen ve diğer daha elektropozitif elementler de w = -1'e sahiptir.
3. Konvansiyonel bileşiklerde oksijen vardır. w \u003d -2 (istisnalar hidrojen peroksit ve türevleridir - oksijenin -1 oksidasyon durumuna sahip olduğu H 2 O 2 veya BaO 2 ve oksijenin oksidasyon durumunun + olduğu oksijen florür OF 2 2).
4. Alkali (Li - Fr) ve alkali toprak (Ca - Ra) metalleri her zaman grup numarasına eşit, yani sırasıyla +1 ve +2 oksidasyon durumuna sahiptir;
5. Al, Ga, In, Sc, Y, La ve lantanitler (Ce hariç) - w = +3.
6. Bir elementin en yüksek oksidasyon durumu, periyodik sistemin grup numarasına eşittir ve en düşük = (grup numarası - 8). Örneğin, SO 3'te en yüksek w (S) \u003d +6, H 2 S'de en düşük w \u003d -2.
7. Basit maddelerin oksidasyon durumları sıfıra eşit alınır.
8. İyonların oksidasyon durumları yüklerine eşittir.
9. Bileşikteki elementlerin oksidasyon durumları, bir moleküldeki veya nötr bir formül birimindeki tüm atomlar için toplamları sıfır ve bir iyon için - yükü olacak şekilde birbirini dengeler. Bu, bilinenlerden bilinmeyen bir oksidasyon durumunu belirlemek ve çok elementli bileşikleri formüle etmek için kullanılabilir.
Örnek 2 K 2 CrO 4 tuzundaki ve Cr 2 O 7 2 - iyonundaki kromun oksidasyon derecesini belirleyin.
Karar. w (K) \u003d +1; w (O) \u003d -2'yi kabul ediyoruz. K 2 CrO 4 yapısal birimi için elimizde:
2 .
(+1) + X + 4 .
(-2) \u003d 0, dolayısıyla X \u003d w (Cr) \u003d +6.
Cr 2 O 7 2 iyonu için - elimizde: 2 .
X + 7 .
(-2) \u003d -2, X \u003d w (Cr) \u003d +6.
Yani, kromun oksidasyon durumu her iki durumda da aynıdır.
Örnek 3 P 2 O 3 ve PH 3 bileşiklerinde fosforun oksidasyon durumunu belirleyin.
Karar. Bağlantıda P 2 O 3 w (O) \u003d -2. Molekülün oksidasyon durumlarının cebirsel toplamının sıfıra eşit olması gerektiği gerçeğine dayanarak, fosforun oksidasyon durumunu buluruz: 2. X + 3 . (-2) \u003d 0, dolayısıyla X \u003d w (P) \u003d +3.
PH 3 bileşiğinde w(H) = +1, dolayısıyla X + 3. (+1) = 0. X = w (P) = -3.
Örnek 4 Aşağıda listelenen hidroksitlerin termal bozunmasıyla elde edilebilecek oksitlerin formüllerini yazınız:
H2Si03; Fe(OH)3; H3As04; H2W04; Cu(OH)2.
Karar. H 2 SiO 3 - silikonun oksidasyon durumunu belirleyin: w (H) \u003d +1, w (O) \u003d -2, buradan: 2. (+1) + X + 3 . (-2) = 0.w(Si) = X = +4. Oksit-SiO 2 formülünü oluşturuyoruz.
Fe (OH) 3 - hidrokso grubunun yükü -1'dir, bu nedenle w (Fe) \u003d +3 ve karşılık gelen oksidin formülü Fe203'tür.
H3 AsO 4 - asitte arseniğin oksidasyon derecesi: 3. (+1) +X+ 4 . (-2) = 0.X=w(As) = +5. Böylece oksidin formülü As 2 O 5'tir.
Asit içindeki H2WO4-w(W) +6'dır, dolayısıyla karşılık gelen oksidin formülü W03'tür.
Cu (OH) 2 - yükü -1 olan iki hidrokso grubu olduğundan, bu nedenle w (Cu) \u003d +2 ve oksit formülü -CuO'dur.
Çoğu elementin birden fazla oksidasyon durumu vardır.
D.I. tablosunu kullanarak nasıl olduğunu düşünün. Mendeleev'e göre elementlerin ana oksidasyon durumlarını belirlemek mümkündür.
Kararlı oksidasyon durumları ana alt grupların elemanları aşağıdaki kurallara göre belirlenebilir:
1.
I-III gruplarının elemanları, yalnızca oksidasyon durumlarına sahiptir - pozitif ve grup numaralarına eşit büyüklükte (w \u003d +1 ve +3 olan talyum hariç).
IV-VI gruplarının elemanları için, grup numarasına karşılık gelen pozitif oksidasyon durumuna ve 8 sayısı ile grup numarası arasındaki farka eşit olan negatif bir oksidasyon durumuna ek olarak, genellikle 2 ile farklılık gösteren ara oksidasyon durumları da vardır. birimler. IV. grup için oksidasyon durumları sırasıyla +4, +2, -2, -4'tür; V grubunun elemanları için sırasıyla -3, -1 +3 +5; ve grup VI için - +6, +4, -2.
3.
Grup VII elementleri, +7'den -1'e kadar tüm oksidasyon durumlarına sahiptir, iki birim farklıdır, yani. +7,+5, +3, +1 ve -1. Halojenler grubunda, pozitif oksidasyon durumuna sahip olmayan flor salınır ve diğer elementlerle bileşiklerde sadece bir oksidasyon durumunda -1 bulunur. (Eşit oksidasyon durumlarına sahip birkaç halojen bileşiği vardır: ClO, ClO 2, vb.)
Elementler yan alt gruplar kararlı oksidasyon durumları ve grup numarası arasında basit bir ilişki yoktur. İkincil alt grupların bazı elemanları için, kararlı oksidasyon durumları basitçe hatırlanmalıdır. Bu unsurlar şunları içerir:
Cr (+3 ve +6), Mn (+7, +6, +4 ve +2), Fe, Co ve Ni (+3 ve +2), Cu (+2 ve +1), Ag (+1 ), Au (+3 ve +1), Zn ve Cd (+2), Hg (+2 ve +1).
Üç ve çok elementli bileşiklerin yükseltgenme durumlarına göre formüllerini hazırlamak için tüm elementlerin yükseltgenme durumlarını bilmek gerekir. Bu durumda, formüldeki elementlerin atom sayısı, tüm atomların oksidasyon durumlarının toplamının formül biriminin (molekül, iyon) yüküne eşit olması koşulundan belirlenir. Örneğin, yüksüz bir formül biriminde, oksidasyon durumları sırasıyla +1, +6 ve -2'ye eşit olan K, Cr ve O atomları olduğu biliniyorsa, bu koşul K2CrO 4 formülleriyle karşılanacaktır. , K 2 Cr 2 O 7 , K 2 Cr 3 O 10 ve diğerleri; -2 yüklü bu iyona benzer şekilde, Cr +6 ve O - 2 içeren, CrO 4 2 -, Cr 2 O 7 2 -, Cr 3 O 10 2 -, Cr 4 O 13 2 -, vb. karşılık gelecek.

3. Elektronik değerlik V  - belirli bir atom tarafından oluşturulan kimyasal bağların sayısı.
- belirli bir atom tarafından oluşturulan kimyasal bağların sayısı.
Örneğin, H 2 O 2 H ¾ O molekülünde
V stx (O) \u003d 1, V c.h. (O) \u003d 2, V  .(O) = 2
.(O) = 2
Yani, stokiyometrik ve elektronik değerlerin uyuşmadığı kimyasal bileşikler vardır; bunlara örneğin karmaşık bileşikler dahildir.
Koordinasyon ve elektronik değerlik, “Kimyasal bağ” ve “Kompleks bileşikler” konularında daha ayrıntılı olarak tartışılmaktadır.
Talimat
Tablo, kimyasal elementlerin ilke ve kanunlarına göre yer aldığı bir yapıdır. Yani, kimyasal elementlerin "yaşadığı" ve her birinin kendine ait olduğu çok katlı bir "ev" olduğunu söyleyebiliriz. kendi daire Belirli bir sayının altında. Yatay olarak, küçük ve büyük olabilen "zeminler" vardır. Periyot iki satırdan oluşuyorsa (yan tarafta numaralandırma ile gösterilir), o zaman böyle bir periyoda büyük denir. Sadece bir satırı varsa, o zaman küçük olarak adlandırılır.
Tablo ayrıca "girişlere" ayrılmıştır - bunlardan yalnızca sekizi olan gruplar. Her girişte olduğu gibi daireler sağda ve solda yer alıyor ve burada da kimyasal elementler aynı şekilde yer alıyor. Sadece bu versiyonda, yerleşimleri düzensizdir - bir yandan daha fazla öğe vardır ve daha sonra ana gruptan daha az bahsederler ve bu, grubun ikincil olduğunu gösterir.
Değerlik, elementlerin oluşturma yeteneğidir. Kimyasal bağlar. Değişmeyen bir sabit ve değişen bir değişken var. farklı anlam elementin içinde bulunduğu maddeye göre değişir. Periyodik tabloya göre değerlik belirlenirken, aşağıdaki özelliklere dikkat etmek gerekir: elementlerin grup numarası ve türü (yani ana veya yan grup). Bu durumda sabit değerlik, ana alt grubun grup numarası ile belirlenir. Değişken değerlik değerini bulmak için (eğer varsa ve genellikle y varsa), o zaman elemanın bulunduğu grubun sayısını 8'den çıkarmanız gerekir (toplam 8 - dolayısıyla böyle bir rakam).
Örnek No. 1. Ana alt grubun (alkali) ilk grubunun elemanlarına bakarsanız, hepsinin I'e (Li, Na, K, Rb, Cs, Fr) eşit bir değerliğe sahip olduğu sonucuna varabiliriz.
Örnek No. 2. Ana alt grubun (alkali toprak metalleri) ikinci grubunun elemanları, sırasıyla, II (Be, Mg, Ca, Sr, Ba, Ra) değerine sahiptir.
Örnek No. 3. Metal olmayanlar hakkında konuşursak, örneğin, P (fosfor) ana alt grubun V grubundadır. Buradan, değeri V'ye eşit olacaktır. Ek olarak, fosforun başka bir değerlik değeri vardır ve bunu belirlemek için 8 - element numarası eylemini gerçekleştirmelisiniz. Dolayısıyla, 8 - 5 (grup numarası) \u003d 3. Bu nedenle, ikinci fosfor değeri III'tür.
Örnek No. 4. Halojenler, ana alt grubun grup VII'sindedir. Bu nedenle, değerleri VII'ye eşit olacaktır. Bununla birlikte, bunların metal olmadığı göz önüne alındığında, aritmetik bir işlem yapılması gerekir: 8 - 7 (eleman grubu numarası) \u003d 1. Bu nedenle, diğer değerlik I'e eşittir.
İkincil alt grupların elemanları için (ve sadece onlar için metaller), özellikle çoğu durumda I, II, daha az sıklıkla III'e eşit olduğu için değerlik hatırlanmalıdır. Ayrıca ikiden fazla değeri olan kimyasal elementlerin değerlerini de ezberlemeniz gerekecektir.
İlgili videolar
Not
Metalleri ve metal olmayanları tanımlarken dikkatli olun. Bunun için genellikle tabloda semboller verilmiştir.
Kaynaklar:
- periyodik tablonun elementleri nasıl doğru telaffuz edilir
- fosforun değeri nedir? X
Okuldan ve hatta daha öncesinden herkes, kendimiz de dahil olmak üzere etrafımızdaki her şeyin atomlarından - en küçük ve bölünmez parçacıklardan - oluştuğunu bilir. Atomların birbirleriyle bağlantı kurma yeteneği sayesinde dünyamızın çeşitliliği muazzamdır. Bu kimyasal atomların yeteneği eleman diğer atomlarla bağ oluşturur değerlik eleman.
Talimat
Tablodaki her öğeye belirli bir seri numarası atanır (H - 1, Li - 2, Be - 3, vb.). Bu sayı çekirdeğe (çekirdekteki proton sayısı) ve çekirdeğin etrafında dönen elektron sayısına karşılık gelir. Böylece proton sayısı elektron sayısına eşittir ve bu, normal koşullar altında atomun elektriksel olduğunu gösterir.
Yedi periyoda bölünme, atomun enerji düzeylerinin sayısına göre gerçekleşir. İlk periyodun atomları tek seviyeli bir elektron kabuğuna, ikincisi - iki seviyeli, üçüncü - üç seviyeli vb. Yeni bir enerji seviyesi dolduğunda, yeni bir dönem başlar.
Herhangi bir dönemin ilk elementleri, dış seviyede bir elektronu olan atomlarla karakterize edilir - bunlar alkali metal atomlarıdır. Periyotlar, tamamen elektronlarla dolu bir dış enerji seviyesine sahip olan soy gazların atomlarıyla sona erer: ilk periyotta, inert gazların 2 elektronu vardır, sonrakilerde - 8. Bu tam olarak elektron kabuklarının benzer yapısından kaynaklanmaktadır. element gruplarının benzer fiziko-.
Tabloda D.I. Mendeleyev'in 8 ana alt grubu vardır. Sayıları, enerji seviyesindeki mümkün olan maksimum elektron sayısından kaynaklanmaktadır.
Periyodik tablonun alt kısmında, lantanitler ve aktinitler bağımsız seriler olarak seçilmiştir.
Tabloyu kullanma D.I. Mendeleev'e göre, elementlerin aşağıdaki özelliklerinin periyodikliği gözlemlenebilir: bir atomun yarıçapı, bir atomun hacmi; iyonlaşma potansiyeli; elektron ilgi kuvvetleri; atomun elektronegatifliği; ; fiziksel özellikler potansiyel bileşikler.
Tablo D.I.'deki elementlerin düzenlenmesinde açıkça izlenen bir periyodiklik. Mendeleev, enerji seviyelerinin elektronlar tarafından doldurulmasının tutarlı doğası ile rasyonel olarak açıklanmaktadır.
Kaynaklar:


 - belirli bir atom tarafından oluşturulan kimyasal bağların sayısı.
- belirli bir atom tarafından oluşturulan kimyasal bağların sayısı. .(O) = 2
.(O) = 2