Saidi jaotised
Toimetaja valik:
- Vene keele õigekirja ja kirjavahemärkide reeglid (1956)
- Kas lesk koos lapsega on võimalik vallandada?
- Pärasoole limaskesta kahjustuse ravi Peaaegu kannatas pärasoole rebend
- Kas planeedil seisab ees III maailmasõda?
- Soodoma ja Gomorra ajalugu
- Püha Vaim – miks me seda vajame Kes on kristlikus teaduses püha vaim
- Kunstlikud taevavalgustuse tsoonid
- Baikonuri kosmodroom – esimene kosmodroom maailmas
- Transuraanielemendid Miks on siirdemetallid halvad
- Kosmoselift ja nanotehnoloogia Orbitaallift
Reklaam
| Vääveloksiid looduses ja inimese elus. Väävel(IV)oksiid ja väävelhape |
|
Suurem osa väävel(IV)oksiidist kasutatakse väävelhappe tootmiseks. Väävel(IV)oksiidi kasutatakse ka erinevate väävelhappe soolade saamiseks. Väävelhappel on reaktsioonides aluste ja aluseliste oksiididega happelised omadused. Kuna väävelhape on kahealuseline, moodustab see kaks soolade seeriat: keskmised - sulfaadid, näiteks Na2SO4, ja happelised - hüdrosulfaadid, näiteks NaHSO4. Samuti lahustub see etanoolis ja väävelhappes. Tugevate redutseerivate ainete juuresolekul on SO2 võimeline avaldama oksüdeerivaid omadusi. Väävelhappe aerosooli väljalangemist keemiatehaste suitsurakettidest täheldatakse sagedamini madalatel pilvedel ja kõrge õhuniiskusõhku.
Vääveldioksiid saavutab suurima kontsentratsiooni põhjapoolkeral, eriti USA, Euroopa, Hiina, Venemaa Euroopa osa ja Ukraina territooriumil. Väävelhappe ja lahustuvate sulfaatide tuvastamiseks kasutatakse valge BaSO4 sademe moodustumist (hapetes lahustumatu). Väävelhape esineb ainult lahuses. Vääveltrioksiidil on happelised omadused. Seda reaktsiooni kasutatakse keemiatööstuse kõige olulisema toote – väävelhappe – tootmiseks. Kuna vääveltrioksiidis sisalduv väävel on kõrgeim aste oksüdatsiooni, siis väävel(VI)oksiidil on oksüdeerivad omadused. Küsimus: Milliseid hapete keemilisi omadusi te teate? Seda kasutatakse ka säilitusainena (toidulisand E220). Kuna see gaas tapab mikroorganisme, kasutatakse seda köögiviljapoodide ja ladude fumigeerimiseks. Värvilise ja musta metallurgia pürometallurgia ettevõtted, samuti soojuselektrijaamad paiskavad igal aastal atmosfääri kümneid miljoneid tonne väävelanhüdriidi. 4. Väävli iseoksüdeerumise-redutseerumise reaktsioonid on võimalikud ka siis, kui see interakteerub sulfitidega. Seega võivad SO2, väävelhappel ja selle sooladel olla nii oksüdeerivad kui ka redutseerivad omadused. Vesiniksulfiidi kasutatakse väävli, sulfitide, tiosulfaatide ja väävelhappe tootmiseks ning laboripraktikas sulfiidide sadestamiseks. Seda kasutatakse fosfor-, vesinikkloriid-, boor-, vesinikfluoriid- ja muude hapete tootmisel. Sellel on tüüpilised happeliste oksiidide omadused ja see lahustub hästi vees, moodustades nõrga väävelhappe. Keemilised omadused väävelhappe sisaldus sõltub suuresti selle kontsentratsioonist. Vasksulfaati CuSO4 5H2O kasutatakse põllumajanduses kahjurite ja taimehaiguste vastu võitlemiseks.
Väävliühendid oksüdatsiooniastmega +13. Kirjutage reaktsioonivõrrandid, mis iseloomustavad lahjendatud väävelhappe kui elektrolüüdi omadusi. Plastiline väävel on tumedat värvi ja võib venitada nagu kumm. Ühe oksiidi oksüdeerumisprotsess teiseks on pöörduv. Termilised mõjud keemilised reaktsioonid. Perioodilised muutused oksiidide, hüdroksiidide, vesinikuühendite omadustes keemilised elemendid. Vesiniku füüsikalised ja keemilised omadused. Lahustub vees, moodustades ebastabiilse väävelhappe; lahustuvus 11,5 g/100 g vees 20 °C juures, väheneb temperatuuri tõustes. Seda vääveldioksiidi vasodilateerivat toimet vahendavad ATP-tundlikud kaltsiumikanalid ja L-tüüpi kaltsiumikanalid ("dihüdropüridiin"). Maa atmosfääris leiduv vääveldioksiid nõrgendab oluliselt kasvuhoonegaaside (süsinikdioksiid, metaan) mõju atmosfääritemperatuuri tõusule. Vääveltrioksiidi vormide mitmekesisus on seotud doonor-aktseptor sidemete moodustumisega SO3 molekulide polümeriseerumisvõimega. SO3 polümeersed struktuurid muutuvad kergesti üksteiseks ja tahke SO3 koosneb tavaliselt segust erinevaid vorme, mille suhteline sisaldus sõltub väävelanhüdriidi saamise tingimustest. Raudsulfaati FeSO4 7H2O kasutati varem sügeliste, helmintiaaside ja näärmekasvajate raviks ning praegu kasutatakse seda põllumajanduslike kahjurite tõrjeks. Glauberi soola (mirabiliit) Na2SO4 10H2O sai saksa keemik I.R. Glauber väävelhappe toimel naatriumkloriidiga, seda kasutatakse lahtistina.
See on ebastabiilne ja laguneb vääveldioksiidiks ja veeks. Väävelhape ei ole tugev hape. See on keskmise tugevusega hape ja dissotsieerub järk-järgult. Väävelhape reageerib kolme tüüpi: hape-alus, ioonivahetus, redoks. Neid reaktsioone on kõige parem läbi viia lahjendatud väävelhappega. Väävelhapet iseloomustavad ioonivahetusreaktsioonid. Gaaside eraldumine toimub reaktsioonides ebastabiilsete hapete sooladega, mis lagunevad gaasideks (süsinik, vääveldioksiid, vesiniksulfiid) või lenduvate hapete, näiteks vesinikkloriidhappe moodustamiseks. Tähelepanu! Slaidide eelvaated on ainult informatiivsel eesmärgil ja ei pruugi esindada kõiki esitluse funktsioone. Ülesanne: Kirjutage väävelhappe dissotsiatsiooni võrrand.
Huvitaval kombel on üksikisikute, loomade ja taimede tundlikkus SO2 suhtes väga erinev. Naatriumtiosulfaat sisaldab kahte väävliaatomit erinevates oksüdatsiooniastmetes ja sellel on redutseerivad omadused. SO2 muudab värvituks orgaanilised värvained ning seda kasutatakse siidi, villa ja põhu pleegitamiseks. Kontsentreeritud väävelhapet kasutatakse naftasaaduste puhastamiseks väävlist ja küllastumata orgaanilised ühendid. Tänu oma kõrgele hügroskoopsusele kasutatakse seda gaaside kuivatamiseks ja kontsentreerimiseks lämmastikhape. Vesiniksulfiid ja sulfiidid. Vesiniksulfiidi lahustamisel vees moodustub nõrk vesiniksulfiidhape, mille sooli nimetatakse sulfiidideks. Väävelhappe kui kahealuselise happe soolad võivad olla keskmised - sulfitid, näiteks naatriumsulfit Na2SO3, ja happelised - vesiniksulfitid, näiteks naatriumvesiniksulfit NaHSO3. Seda kasutatakse ka lahustina laborites. Õpetaja: Väävelhape on ebastabiilne ühend, laguneb kergesti vääveloksiidiks (IV) ja veeks, seetõttu esineb seda ainult vesilahustes. Absorptsioonitornis neelab vääveloksiid (VI) kontsentreeritud väävelhappega. aastal saadud hariduse tõttu suured kogused Jäätmena on vääveldioksiid üks peamisi atmosfääri saastavaid gaase. Vääveloksiid (vääveldioksiid, vääveldioksiid, vääveldioksiid) on värvitu gaas, millel on tavatingimustes terav iseloomulik lõhn (sarnane põleva tiku lõhnaga). Surve all veeldatud toatemperatuur. Vääveldioksiid lahustub vees ja moodustub ebastabiilne väävelhape. See aine lahustub ka väävelhappes ja etanoolis. See on üks peamisi komponente, mis moodustavad vulkaanilisi gaase. Vääveldioksiid SO2 – vääveldioksiidi – saamine tööstuslikult koosneb väävli põletamisest või sulfiidide röstimisest (kasutatakse peamiselt püriiti). 4FeS2 (püriit) + 11O2 = 2Fe2O3 + 8SO2 (vääveldioksiid). Laboritingimustes saab vääveldioksiidi toota hüdrosulfitide ja sulfitide töötlemisel tugevate hapetega. Sel juhul laguneb tekkiv väävelhape koheselt veeks ja vääveldioksiidiks. Näiteks: Na2SO3 + H2SO4 (väävelhape) = Na2SO4 + H2SO3 (väävelhape). Kolmas vääveldioksiidi valmistamise meetod hõlmab kontsentreeritud väävelhappe mõju madala aktiivsusega metallidele kuumutamisel. Näiteks: Cu (vask) + 2H2SO4 (väävelhape) = CuSO4 (vasksulfaat) + SO2 (vääveldioksiid) + 2H2O (vesi). Vääveldioksiidi keemilised omadused Vääveldioksiidi valem on SO3. See aine kuulub happeoksiidide hulka. 1. Vääveldioksiid lahustub vees, moodustades väävelhappe. Normaalsetes tingimustes on see reaktsioon pöörduv. SO2 (vääveldioksiid) + H2O (vesi) = H2SO3 (väävelhape). 2. Leelistega moodustab vääveldioksiid sulfiteid. Näiteks: 2NaOH (naatriumhüdroksiid) + SO2 (vääveldioksiid) = Na2SO3 (naatriumsulfit) + H2O (vesi). 3. Vääveldioksiidi keemiline aktiivsus on üsna kõrge. Vääveldioksiidi redutseerivad omadused on kõige selgemad. Sellistes reaktsioonides suureneb väävli oksüdatsiooniaste. Näiteks: 1) SO2 (vääveldioksiid) + Br2 (broom) + 2H2O (vesi) = H2SO4 (väävelhape) + 2HBr (vesinikbromiid); 2) 2SO2 (vääveldioksiid) + O2 (hapnik) = 2SO3 (sulfit); 3) 5SO2 (vääveldioksiid) + 2KMnO4 (kaaliumpermanganaat) + 2H2O (vesi) = 2H2SO4 (väävelhape) + 2MnSO4 (mangaansulfaat) + K2SO4 (kaaliumsulfaat). Viimane reaktsioon on näide kvalitatiivsest reaktsioonist SO2 ja SO3 suhtes. Lahus muutub lillaks.) 4. Tugevate redutseerivate ainete juuresolekul võib vääveldioksiid avaldada oksüdeerivaid omadusi. Näiteks väävli eraldamiseks heitgaasidest metallurgiatööstuses kasutavad nad vääveldioksiidi redutseerimist süsinikmonooksiidiga (CO): SO2 (vääveldioksiid) + 2CO (süsinikmonooksiid) = 2CO2 + S (väävel). Samuti kasutatakse fosforhappe saamiseks selle aine oksüdeerivaid omadusi: PH3 (fosfiin) + SO2 (vääveldioksiid) = H3PO2 (fosforhape) + S (väävel). Kus kasutatakse vääveldioksiidi? Vääveldioksiidi kasutatakse peamiselt väävelhappe tootmiseks. Seda kasutatakse ka madala alkoholisisaldusega jookide (vein ja muud keskmise hinnaga joogid) tootmisel. Selle gaasi omaduse tõttu tappa erinevaid mikroorganisme kasutatakse seda fumigeerimiseks laod ja köögiviljahoidla. Lisaks kasutatakse vääveloksiidi villa, siidi ja õlgede (need materjalid, mida ei saa klooriga pleegitada) pleegitamiseks. Laborites kasutatakse vääveldioksiidi lahustina ja erinevate vääveldioksiidi soolade saamiseks. Füsioloogilised mõjud Vääveldioksiidil on tugevad toksilised omadused. Mürgistuse sümptomiteks on köha, nohu, häälekähedus, omapärane maitse suus ja tugev kurguvalu. Vääveldioksiidi sissehingamisel suurtes kontsentratsioonides tekivad neelamis- ja lämbumisraskused, kõnehäired, iiveldus ja oksendamine ning võib tekkida äge kopsuturse. Vääveldioksiidi MPC: Tundlikkus vääveldioksiidi suhtes on üksikisikute, taimede ja loomade lõikes erinev. Näiteks puudest on kõige vastupidavamad tamm ja kask ning kõige vähem vastupidavad kuusk ja mänd. Sellest artiklist leiate teavet selle kohta, mis on vääveloksiid. Arvesse võetakse selle põhilisi keemilisi ja füüsikalisi omadusi, olemasolevaid vorme, nende valmistamise meetodeid ja erinevusi üksteisest. Samuti mainitakse selle oksiidi rakendusi ja bioloogilist rolli selle erinevates vormides. Mis on aineVääveloksiid on lihtainete, väävli ja hapniku ühend. Vääveloksiididel on kolm vormi, mis erinevad valentsi S astme poolest, nimelt: SO (väävelmonooksiid, väävelmonooksiid), SO 2 (vääveldioksiid või vääveldioksiid) ja SO 3 (vääveltrioksiid või -anhüdriid). Kõigil loetletud vääveloksiidide variatsioonidel on sarnased keemilised ja füüsikalised omadused. Üldteave väävelmonooksiidi kohtaKahevalentne väävelmonooksiid või muul viisil väävelmonooksiid on anorgaaniline aine, mis koosneb kahest lihtsast elemendist - väävlist ja hapnikust. Valem – SO. Tavatingimustes on see värvitu, kuid terava ja spetsiifilise lõhnaga gaas. Reageerib vesilahusega. Üsna haruldane ühend maakera atmosfääris. See on temperatuuri suhtes ebastabiilne ja eksisteerib dimeerses vormis - S 2 O 2 . Mõnikord on see võimeline suhtlema hapnikuga, moodustades reaktsiooni tulemusena vääveldioksiidi. Ei moodusta sooli.
Vääveloksiidi (2) saadakse tavaliselt väävli põletamisel või selle anhüdriidi lagundamisel:
Aine lahustub vees. Selle tulemusena moodustab vääveloksiid tioväävelhapet:
Üldandmed vääveldioksiidi kohtaVääveloksiid on veel üks vääveloksiidide vorm keemiline valem SO2. Sellel on ebameeldiv spetsiifiline lõhn ja see on värvitu. Surve allumisel võib see toatemperatuuril süttida. Vees lahustatuna moodustab see ebastabiilse väävelhappe. Võib lahustuda etanooli ja väävelhappe lahustes. See on vulkaanilise gaasi koostisosa.
Tööstuses saadakse seda väävli põletamisel või selle sulfiidide röstimisel:
Laborites saadakse SO 2 reeglina sulfitide ja hüdrosulfitide abil, puutudes kokku tugeva happega, aga ka madala aktiivsusega metallide kokkupuutel kontsentreeritud H 2 SO 4-ga. Nagu teisedki vääveloksiidid, on SO2 happeline oksiid. Suheldes leelistega, moodustades erinevaid sulfiteid, reageerib see veega, moodustades väävelhapet. SO 2 on äärmiselt aktiivne ja see väljendub selgelt selle redutseerivates omadustes, kus vääveloksiidi oksüdatsiooniaste suureneb. Tugeva redutseerijaga kokkupuutel võib avaldada oksüdeerivaid omadusi. Viimane iseloomulik tunnus kasutatakse hüpofosforhappe tootmiseks või S eraldamiseks gaasidest metallurgia valdkonnas. Vääveloksiidi (4) kasutavad inimesed laialdaselt väävelhappe või selle soolade tootmiseks - see on selle peamine kasutusvaldkond. Ta osaleb ka veinivalmistamise protsessides ja toimib seal säilitusainena (E220) kasutatakse mõnikord juurviljade ja ladude marineerimiseks, kuna see hävitab mikroorganisme. Materjale, mida ei saa klooriga pleegitada, töödeldakse vääveloksiidiga.
SO 2 on üsna mürgine ühend. Mürgistusele viitavad iseloomulikud sümptomid on köha, hingamisprobleemid, tavaliselt nohu kujul, häälekähedus, ebatavaline maitse ja kurguvalu. Selle gaasi sissehingamine võib põhjustada lämbumist, kõnevõime halvenemist, oksendamist, neelamisraskusi ja kopsuturset. äge vorm. Selle aine maksimaalne lubatud kontsentratsioon tööpiirkonnas on 10 mg/m3. Erinevate inimeste kehad võivad aga vääveldioksiidi suhtes olla erineva tundlikkusega. Üldteave väävelanhüdriidi kohtaVäävelgaas või väävelanhüdriid, nagu seda nimetatakse, on kõrgem väävlioksiid keemilise valemiga SO 3 . Lämmatava lõhnaga vedelik, väga lenduv, kui standardtingimused. Temperatuuril 16,9 °C ja alla selle on see võimeline tahkestuma, moodustades oma tahketest modifikatsioonidest kristalseid segusid.
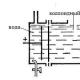
Kõrgema oksiidi üksikasjalik analüüsKui SO 2 oksüdeerub õhuga kõrgete temperatuuride mõjul, vajalik tingimus on katalüsaatori olemasolu, näiteks V2O5, Fe2O3, NaVO3 või Pt. Sulfaatide termiline lagunemine või osooni ja SO 2 interaktsioon:
SO 2 oksüdeerimine NO 2 -ga:
Füüsikaliste kvalitatiivsete omaduste hulka kuuluvad: lameda struktuuri olemasolu gaasilises olekus, trigonaalne tüüp ja D 3 h sümmeetria gaasist kristallile või vedelikule üleminekul, see moodustab tsüklilise iseloomuga trimeeri ja siksakahela ning sellel on kovalentne polaarne side. Tahkel kujul esineb SO 3 alfa-, beeta-, gamma- ja sigma kujul ning sellel on vastavalt erinevad sulamistemperatuurid, polümerisatsiooniastmed ja mitmesugused kristalsed vormid. Sellise arvu SO 3 tüüpide olemasolu on tingitud doonor-aktseptor tüüpi sidemete moodustumisest. Väävelanhüdriidi omadused hõlmavad paljusid selle omadusi, millest peamised on: Võimalus suhelda aluste ja oksiididega:
Kõrgem vääveloksiid SO3 on üsna kõrge aktiivsusega ja tekitab veega suhtlemisel väävelhapet:
See reageerib vesinikkloriidiga ja moodustab klorosulfaathappe:
Vääveloksiidi iseloomustavad tugevad oksüdeerivad omadused. Väävelhappe valmistamisel kasutatakse väävelhappe anhüdriidi. Väike kogus seda vabaneb keskkond väävlipomme kasutades. SO 3, moodustades märja pinnaga kokkupuutel väävelhapet, hävitab mitmesuguseid ohtlikke organisme, näiteks seeni. Kokkuvõtteid tehesVääveloksiidi võib leida erinevatest agregatsiooniseisundid vedelalt tahkeks. Looduses on see haruldane, kuid tööstuses ja ka piirkondades, kus seda saab kasutada, on selle hankimiseks üsna palju võimalusi. Oksiidil endal on kolm erinevat valentsivormi. Võib olla väga mürgine ja põhjustada tõsiseid terviseprobleeme. Väävli oksüdatsiooniaste +4 on üsna stabiilne ja avaldub SHal 4 tetrahalogeniidides, SOHal 2 oksodihaliidides, SO 2 dioksiidis ja nende vastavates anioonides. Tutvume vääveldioksiidi ja väävelhappe omadustega. 1.11.1. Vääveloksiid (IV) So2 molekuli struktuurSO 2 molekuli struktuur on sarnane osooni molekuli struktuuriga. Väävliaatom on sp 2 hübridisatsiooni olekus, orbitaalide kuju on korrapärane kolmnurk ja molekuli kuju on nurgeline. Väävliaatomil on üksik elektronide paar. S-O sideme pikkus on 0,143 nm ja sideme nurk on 119,5°. Struktuur vastab järgmistele resonantsstruktuuridele: Erinevalt osoonist on S-O sideme kordsus 2, see tähendab, et peamise panuse annab esimene resonantsstruktuur. Molekuli iseloomustab kõrge termiline stabiilsus. Füüsikalised omadusedTavatingimustes on vääveldioksiid ehk vääveldioksiid värvitu terava lämmatava lõhnaga gaas, sulamistemperatuur -75 °C, keemistemperatuur -10 °C. See lahustub hästi vees temperatuuril 20 °C, 40 mahuosa vääveldioksiidi lahustub 1 mahus vees. Mürgine gaas. Väävel(IV)oksiidi keemilised omadusedVääveldioksiid on väga reaktsioonivõimeline. Vääveldioksiid on happeline oksiid. See on vees üsna lahustuv, moodustades hüdraate. Samuti reageerib see osaliselt veega, moodustades nõrga väävelhappe, mida ei eraldata üksikult: SO2 + H2O = H2SO3 = H + + HSO3- = 2H + + SO32-. Dissotsiatsiooni tulemusena tekivad prootonid, mistõttu lahuses on happeline keskkond. Kui gaasiline vääveldioksiid lastakse läbi naatriumhüdroksiidi lahuse, moodustub naatriumsulfit. Naatriumsulfit reageerib liigse vääveldioksiidiga, moodustades naatriumvesiniksulfiti: 2NaOH + SO2 = Na2SO3 + H2O; Vääveldioksiidile on iseloomulik redoks-duaalsus, näiteks sellel on redutseerivad omadused ja see muudab broomvee värvituks: SO2 + Br2 + 2H2O = H2SO4 + 2HBr ja kaaliumpermanganaadi lahus: 5SO2 + 2KMnO4 + 2H2O = 2KНSO4 + 2MnSO4 + H2SO4. hapnikuga oksüdeeritud väävelanhüdriidiks: 2SO 2 + O 2 = 2SO 3. Sellel on oksüdeerivad omadused koostoimes tugevate redutseerivate ainetega, näiteks: SO 2 + 2CO = S + 2CO 2 (temperatuuril 500 °C, Al 2O 3 juuresolekul); SO2 + 2H2 = S + 2H2O. Väävel(IV)oksiidi valmistamineVäävli põlemine õhus S + O 2 = SO 2. Sulfiidne oksüdatsioon 4FeS2 + 11O2 = 2Fe2O3 + 8SO2. Tugevate hapete mõju metallisulfitidele Na2SO3 + 2H2SO4 = 2NaHS04 + H2O + SO2. 1.11.2. Väävelhape ja selle sooladVääveldioksiidi lahustamisel vees moodustub nõrk väävelhape, põhiosa lahustunud SO 2-st on jahutamisel hüdraatunud kujul SO 2 · H 2 O, eraldub ka kristalliline hüdraat, vaid väike osa väävelhappe molekulid dissotsieeruvad sulfiti ja vesiniksulfiti ioonideks. Vabas olekus hape ei eraldu. Olles kahealuseline, moodustab see kahte tüüpi sooli: keskmised - sulfitid ja happelised - hüdrosulfitid. Vees lahustuvad ainult leelismetallide sulfitid ning leelis- ja leelismuldmetallide hüdrosulfitid. Vesiniksulfiid – H2S Väävliühendid -2, +4, +6. Kvalitatiivsed reaktsioonid sulfiididele, sulfitidele, sulfaatidele. Kviitung suhtlemisel: 1. vesinik väävliga temperatuuril t – 300 0 2. toimides mineraalhapete sulfiididele: Na2S+2HCl =2 NaCl+H2S värvitu gaas, mädamunade lõhnaga, mürgine, õhust raskem, lahustub vees, moodustab nõrga vesiniksulfiidhappe. Keemilised omadused Happe-aluse omadused 1. Vesiniksulfiidi lahus vees - vesiniksulfiidhape - on nõrk kahealuseline hape, seetõttu dissotsieerub see järk-järgult: H 2 S ↔ HS - + H + HS - ↔ H - + S 2- 2. Vesiniksulfiidhappel on üldised omadused happed, reageerib metallidega, aluselised oksiidid, alused, soolad: H 2 S + Ca = CaS + H 2 H 2 S + CaO = CaS + H 2 O H2S + 2NaOH = Na2S + 2H2O H 2 S + CuSO 4 = CuS↓ + H 2 SO 4 Kõik happesoolad – vesiniksulfiidid – lahustuvad vees hästi. Tavalised soolad - sulfiidid - lahustuvad vees erineval viisil: leelis- ja leelismuldmetallide sulfiidid lahustuvad hästi, teiste metallide sulfiidid ei lahustu vees ning vase, plii, elavhõbeda ja mõnede teiste raskemetallide sulfiidid ei lahustu isegi vees. happed (va lämmastikhape) CuS+4HNO3 =Cu(NO3)2+3S+2NO+2H2O Lahustuvad sulfiidid hüdrolüüsivad – aniooni juures. Na 2S ↔ 2Na + + S 2- S 2- +HOH ↔HS - +OH - Na 2 S + H 2 O ↔ NaHS + NaOH Kvalitatiivne reaktsioon vesiniksulfiidhappele ja selle lahustuvatele sooladele (st sulfiidioonile S 2-) on nende interaktsioon lahustuvate pliisooladega, mille tulemusena moodustub must PbS sade. Na 2 S + Pb(NO 3) 2 = 2NaNO 3 + PbS↓ Pb 2+ + S 2- = PbS↓
Näitab ainult taastavaid omadusi, sest väävliaatomil on madalaim oksüdatsiooniaste -2 1. hapnikuga a) puudusega 2H2S-2 +O20 = S0 +2H20-2 b) liigse hapnikuga 2H2S+3O2 =2SO2+2H2O 2. halogeenidega (broomivee värvimuutus) H2S-2 +Br2 =S0 +2HBr-1 3. koos konts. HNO3 H2S+2HNO3 (k) = S+2NO2+2H2O b) tugevate oksüdeerivate ainetega (KMnO 4, K 2 CrO 4 happelises keskkonnas) 2KMnO4+3H2SO4+5H2S = 5S+2MnSO4+K2SO4+8H2O c) vesiniksulfiidhapet oksüdeerivad mitte ainult tugevad oksüdeerivad ained, vaid ka nõrgemad, näiteks raud (III) soolad, väävelhape jne. 2FeCl3 + H2S = 2FeCl2 + S + 2HCl H2SO3 + 2H2S = 3S + 3H2O Kviitung 1. väävli põlemine hapnikus. 2. vesiniksulfiidi põletamine liigses O 2 -s 2H2S+3O2 = 2SO2+2H2O 3. sulfiidoksüdatsioon 2CuS+3O2 = 2SO2+2CuO 4. sulfitide vastastikmõju hapetega Na 2 SO 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 + H 2 O 5. metallide vastastikmõju aktiivsusreas pärast (H 2) konts. H2SO4 Cu+2H2SO4 = CuSO4 + SO2 +2H2O Füüsikalised omadused Gaas, värvitu, lämmatava põlenud väävli lõhnaga, mürgine, õhust rohkem kui 2 korda raskem, vees hästi lahustuv (toatemperatuuril lahustub ühes mahus umbes 40 mahuosa gaasi). Keemilised omadused: Happe-aluse omadused SO2 on tüüpiline happeline oksiid. 1. leelistega, moodustades kahte tüüpi sooli: sulfiteid ja hüdrosulfite 2KOH+SO2 = K2SO3+H2O KOH+SO2 = KHS03+H2O 2.aluseliste oksiididega K 2 O+SO 2 = K 2 SO 3 3. veega tekib nõrk väävelhape H2O+SO2 = H2SO3 Väävelhape esineb ainult lahuses ja on nõrk hape. omab kõiki hapete üldisi omadusi. 4. kvalitatiivne reaktsioon sulfitioonile - SO 3 2 - mineraalhapete toime Na 2 SO 3 +2HCl= 2Na 2 Cl+SO 2 +H 2 O põlenud väävli lõhn Redoksi omadused ORR-is võib see olla nii oksüdeerija kui ka redutseerija, kuna SO 2 -s oleva väävliaatomi vahepealne oksüdatsiooniaste on +4. Oksüdeeriva ainena: SO2 + 2H2S = 3S + 2H2S Redutseerijana: 2SO 2 +O 2 = 2SO 3 Cl2 +SO2 +2H2O = H2SO4 +2HCl 2KMnO4 +5SO2 +2H2O = K2SO4 +2H2SO4 +2MnSO4 Vääveloksiid (VI) SO 3 (väävelanhüdriid) Kviitung: Vääveldioksiidi oksüdatsioon 2SO 2 + O 2 = 2SO 3 ( t 0 , kat) Füüsikalised omadused Värvitu vedelik, temperatuuril alla 17 0 C muutub see valgeks kristalseks massiks. Termiliselt ebastabiilne ühend, laguneb täielikult temperatuuril 700 0 C. See lahustub hästi vees ja veevabas väävelhappes ning reageerib sellega, moodustades oleumi SO 3 + H 2 SO 4 = H 2 S 2 O 7 Keemilised omadused Happe-aluse omadused Tüüpiline happeoksiid. 1. leelistega, moodustades kahte tüüpi sooli: sulfaate ja hüdrosulfaate 2KOH+SO3 = K2SO4+H2O KOH+SO3 = KHS04+H2O 2.aluseliste oksiididega CaO + SO 2 = CaSO 4 3. veega H 2 O + SO 3 = H 2 SO 4 Redoksi omadused Vääveloksiid (VI) on tugev oksüdeerija, tavaliselt redutseeritakse SO 2 -ks 3SO3 + H2S = 4SO2 + H2O Väävelhape H2SO4 Väävelhappe valmistamine Tööstuses toodetakse hapet kontaktmeetodil: 1. püriidi põletamine 4FeS2 +11O2 = 2Fe2O3 + 8SO2 2. SO 2 oksüdeerimine SO 3-ks 2SO 2 + O 2 = 2SO 3 ( t 0 , kat) 3. SO 3 lahustamine väävelhappes n SO 3 + H 2 SO 4 = H 2 SO 4 ∙ n SO 3 (oleum) H2SO4∙ n SO3 + H2O = H2SO4 Füüsikalised omadused H 2 SO 4 on raske õline vedelik, lõhnatu ja värvitu, hügroskoopne. See seguneb veega mis tahes vahekorras, kui kontsentreeritud väävelhape vees lahustatakse, eraldub suur kogus soojust, nii et see tuleb hoolikalt vette valada ja mitte vastupidi (kõigepealt vesi, siis hape, muidu juhtub suur häda; ) Väävelhappe lahust vees, mille H 2 SO 4 sisaldus on alla 70%, nimetatakse tavaliselt lahjendatud väävelhappeks, üle 70% - kontsentreeritud. Keemilised omadused Happe-alus Lahjendatud väävelhappel on kõik tugevatele hapetele iseloomulikud omadused. Dissotsieerub vesilahuses: H 2 SO 4 ↔ 2H + + SO 4 2- 1. aluseliste oksiididega MgO + H 2 SO 4 = MgSO 4 + H 2 O 2. põhjendusega 2NaOH +H2SO4 = Na2SO4 + 2H2O 3. sooladega BaCl 2 + H 2 SO 4 = BaSO 4 ↓ + 2HCl Ba 2+ + SO 4 2- = BaSO 4 ↓ (valge sade) Kvalitatiivne reaktsioon sulfaadioonile SO 4 2- Tänu rohkematele kõrge temperatuur keetes, võrreldes teiste hapetega, tõrjub väävelhape kuumutamisel need sooladest välja: NaCl + H2SO4 = HCl + NaHS04 Redoksi omadused Lahjendatud H 2 SO 4-s on oksüdeerijateks H + ioonid ja kontsentreeritud H 2 SO 4-s on oksüdeerijateks SO 4 2 sulfaadiioonid. Aktiivsusreas kuni vesiniku metallid lahustuvad lahjendatud väävelhappes, tekivad sulfaadid ja eraldub vesinik Zn + H2SO4 = ZnSO4 + H2 Kontsentreeritud väävelhape on tugev oksüdeerija, eriti kuumutamisel. See oksüdeerib paljusid metalle, mittemetalle, anorgaanilisi ja orgaanilisi aineid. H 2 SO 4 (k) oksüdeerija S +6 Aktiivsemate metallidega saab väävelhapet olenevalt kontsentratsioonist redutseerida mitmesugusteks toodeteks Zn + 2H 2SO 4 = ZnSO 4 + SO 2 + 2H 2 O 3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O Kontsentreeritud väävelhape oksüdeerib mõned mittemetallid (väävel, süsinik, fosfor jne), redutseerides vääveloksiidiks (IV) S + 2H2SO4 = 3SO2 + 2H2O C + 2H 2SO 4 = 2SO 2 + CO 2 + 2H 2 O Koostoime mõnede keerukate ainetega H2SO4 + 8HI = 4I2 + H2S + 4H2O H2SO4 + 2HBr = Br2 + SO2 + 2H2O Väävelhappe soolad 2 tüüpi sooli: sulfaadid ja hüdrosulfaadid Väävelhappe sooladel on kõik soolade üldised omadused. Nende suhe soojusega on eriline. Aktiivsete metallide sulfaadid (Na, K, Ba) ei lagune isegi kuumutamisel üle 1000 0 C, vähemaktiivsete metallide soolad (Al, Fe, Cu) lagunevad ka vähesel kuumutamisel |
Populaarne:
Ahjus küpsetatud lõhe
|
Uus
- Kas lesk koos lapsega on võimalik vallandada?
- Pärasoole limaskesta kahjustuse ravi Peaaegu kannatas pärasoole rebend
- Kas planeedil seisab ees III maailmasõda?
- Soodoma ja Gomorra ajalugu
- Püha Vaim – miks me seda vajame Kes on kristlikus teaduses püha vaim
- Kunstlikud taevavalgustuse tsoonid
- Baikonuri kosmodroom – esimene kosmodroom maailmas
- Transuraanielemendid Miks on siirdemetallid halvad
- Kosmoselift ja nanotehnoloogia Orbitaallift
- Võimalik missioon: Venemaale on Marsi-ekspeditsioonil määratud võtmeroll